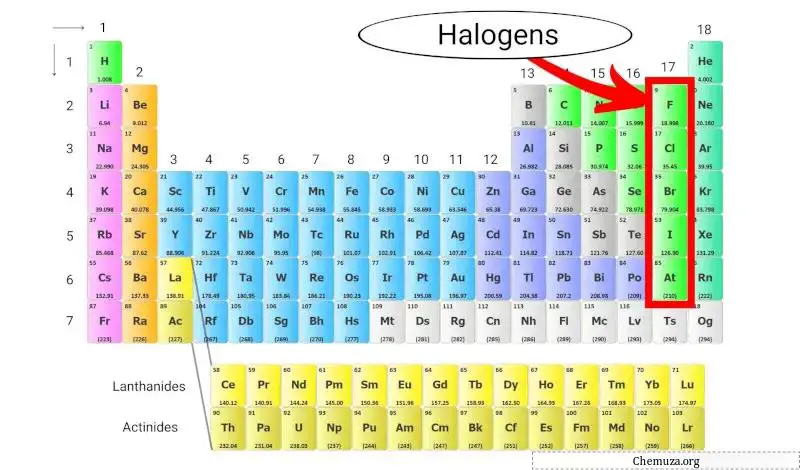
Halogen adalah sekelompok unsur yang terdapat pada golongan 17 (juga disebut golongan halogen) pada tabel periodik . Halogen mencakup lima unsur berbeda: fluor (F), klor (Cl), brom (Br), yodium (I), dan astatin (At).
Halogen unik karena merupakan satu-satunya kelompok unsur yang mampu membentuk senyawa dengan semua unsur lain pada tabel periodik.
Mari kita jelajahi halogen lebih jauh.
Apa itu halogen? Dan mengapa mereka disebut demikian?
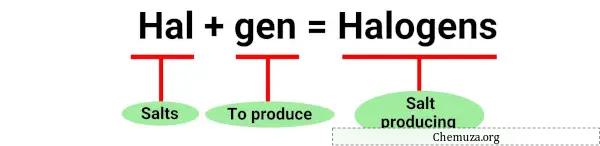
Istilah “halogen” berasal dari kata Yunani “halos” yang berarti garam dan “gen” yang berarti produsen. [1]
Memang, halogen pertama kali ditemukan melalui kemampuannya menghasilkan garam ketika bereaksi dengan logam .
Misalnya:
Ketika klorin (Cl 2 ) bereaksi dengan natrium (Na), ia membentuk natrium klorida (NaCl), yang merupakan garam meja biasa:
2Na + Cl2 → 2NaCl
Demikian pula, ketika brom (Br 2 ) bereaksi dengan kalium (K), membentuk kalium bromida (KBr):
2K + Br2 → 2KBr
Reaksi-reaksi ini adalah contoh halogen yang menghasilkan garam ketika bereaksi dengan logam, oleh karena itu dinamakan “halogen”.
Halogen paling reaktif dalam tabel periodik
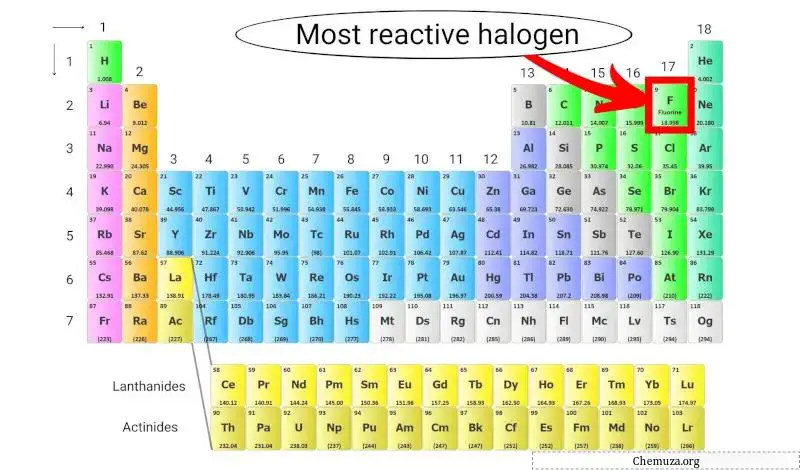
Fluor merupakan halogen yang paling reaktif karena memiliki keelektronegatifan tertinggi di antara semua unsur dalam tabel periodik, sehingga memiliki daya tarik yang kuat terhadap elektron.
Hal ini membuatnya sangat reaktif dan mampu bereaksi dengan hampir semua unsur lain pada tabel periodik untuk membentuk senyawa. [2]
Sederhananya, fluor seperti magnet bagi elektron dan ia akan melakukan apa pun untuk mendapatkan elektron dan melengkapi kulit terluarnya.
Hal ini dilakukan dengan bereaksi dengan unsur lain dan mencuri elektronnya untuk membentuk senyawa baru.
Inilah sebabnya mengapa fluor sangat reaktif dan mengapa ia tidak pernah ditemukan dalam bentuk unsurnya di alam, namun selalu ada sebagai senyawa.
Karena reaktivitasnya yang tinggi, fluorida juga sangat berbahaya dan tidak aman untuk digunakan.
Ini sering ditangani di laboratorium khusus dan digunakan dalam proses industri untuk menghasilkan berbagai macam bahan kimia dan bahan.
Reaktivitas halogen
Halogen sangat reaktif karena elektronegativitasnya lebih tinggi, yang berarti mempunyai kemampuan menarik elektron yang sangat tinggi.
Selain itu, halogen memiliki 7 elektron pada kulit terluarnya, dan hanya memerlukan satu elektron tambahan untuk mengisinya dan mencapai konfigurasi elektronik yang stabil seperti gas mulia .
Misalnya, Anda dapat melihat bahwa diagram Bohr untuk fluor memiliki 7 elektron pada kulit terluarnya.
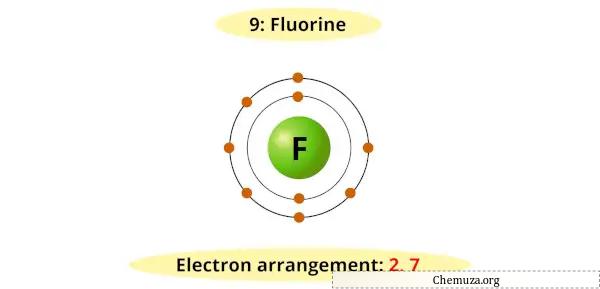
Sekarang dibutuhkan 1 elektron tambahan untuk mendapatkan oktet stabil (7 + 1 = 8).
Halogen bereaksi dengan logam membentuk senyawa ionik yang disebut logam halida , yang dapat menghasilkan nyala api yang terang dan berwarna-warni.
Mereka juga bereaksi dengan non-logam seperti hidrogen , belerang dan nitrogen untuk membentuk berbagai senyawa kovalen. [3]
Oleh karena itu, kecenderungan halogen untuk memperoleh elektron dan memperoleh konfigurasi gas mulia yang stabil menjadikannya sangat reaktif dan mampu membentuk senyawa dengan unsur lain.
Tren Halogen Berkala
Semakin ke bawah golongannya, unsur halogen menunjukkan perubahan sifat fisik dan kimianya.
Mari kita lihat tren beberapa sifat halogen.
- Ukuran atom: Semakin ke bawah golongannya, ukuran atom halogen bertambah. Hal ini karena setiap halogen mempunyai satu tingkat energi lebih banyak daripada tingkat energi di atasnya, yang berarti bahwa elektron terluar berada jauh dari inti.
- Keelektronegatifan: Semakin ke bawah golongan, keelektronegatifan unsur halogen berkurang. Artinya halogen yang berada pada golongan teratas, seperti fluor dan klor, lebih elektronegatif sehingga lebih mungkin menarik elektron dibandingkan halogen pada golongan terbawah, seperti yodium dan astatin.
- Titik Leleh dan Titik Didih: Semakin ke bawah golongannya, titik leleh dan titik didih halogen meningkat. Memang, atom yang lebih besar memiliki lebih banyak elektron dan mampu membentuk gaya antarmolekul yang lebih kuat. [4]
- Reaktivitas terhadap logam: Semakin ke bawah golongannya, reaktivitas halogen terhadap logam menurun. Artinya halogen yang berada pada golongan teratas, seperti fluor dan klor, lebih mungkin bereaksi dengan logam dibandingkan dengan logam yang berada pada golongan terbawah, seperti yodium dan astatin.
Ringkasan
Halogen adalah kelompok lima unsur (fluor, klor, brom, yodium, dan astatin) yang terdapat pada golongan 17 tabel periodik. Mereka unik dalam kemampuannya membentuk senyawa dengan semua unsur lainnya.
Halogen sangat reaktif karena elektronegativitasnya yang tinggi dan kecenderungannya memperoleh elektron untuk mencapai konfigurasi gas mulia yang stabil. Fluor adalah halogen paling reaktif karena elektronegativitasnya yang tinggi.
Ketika bergerak ke bawah golongan, halogen menunjukkan perubahan sifat fisik dan kimianya, seperti peningkatan ukuran atom, penurunan keelektronegatifan, dan peningkatan titik leleh dan titik didih. Reaktivitas halogen terhadap logam juga menurun seiring dengan bertambahnya golongan ke bawah.
