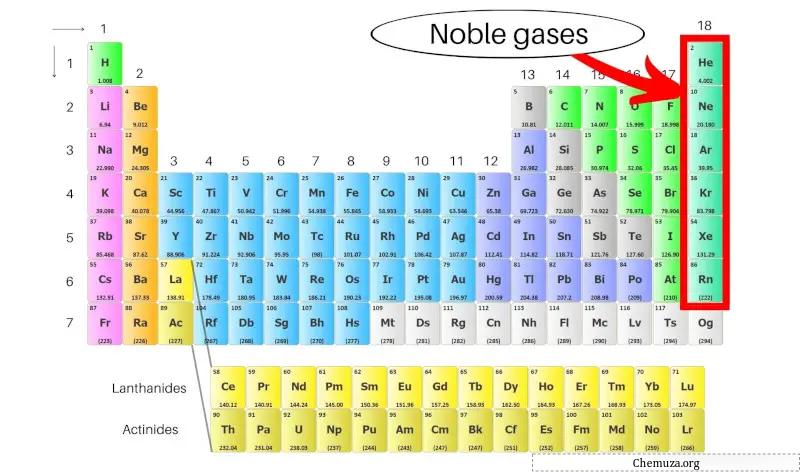
Gas mulia, disebut juga gas inert, adalah sekelompok unsur yang terletak di kolom paling kanan tabel periodik . Mereka termasuk helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) dan radon (Rn).
Unsur-unsur ini dikenal dengan reaktivitasnya yang rendah karena kulit elektron terluarnya yang lengkap, sehingga stabil dan tidak reaktif dengan unsur lain. [1]
Mari kita jelajahi lebih jauh tentang gas mulia pada tabel periodik.
Apa itu gas mulia?
Gas mulia merupakan unsur golongan 18 yang mempunyai ciri kereaktifan yang sangat rendah dengan zat lain, artinya umumnya tidak membentuk senyawa dengan unsur lain.
Disebut juga gas inert karena sangat stabil dan tidak mudah bereaksi dengan zat lain. Gas mulia termasuk helium, neon, argon, kripton, xenon dan radon.
Gas mulia ditemukan dalam jumlah kecil di atmosfer bumi dan digunakan dalam berbagai aplikasi, seperti penerangan, pengelasan, dan kriogenik. [2]
Mengapa gas mulia inert?
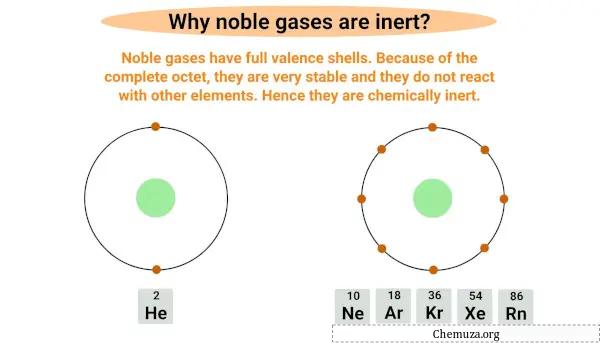
Gas mulia bersifat inert atau non-reaktif karena mempunyai kulit elektron terluar yang lengkap, disebut juga kulit valensi .
Kulit valensi adalah kulit elektron terluar yang mengelilingi atom dan mengandung elektron valensinya , yaitu elektron yang terlibat dalam reaksi kimia.
Gas mulia bersifat oktet penuh, artinya gas mulia memiliki kulit valensi penuh dengan delapan elektron, kecuali helium yang hanya memiliki dua elektron pada kulit terluarnya.
Memiliki byte penuh membuatnya sangat stabil dan tidak mungkin bereaksi dengan elemen lain.
Dalam reaksi kimia, unsur cenderung memperoleh atau kehilangan elektron untuk memperoleh oktet penuh pada kulit valensinya, namun karena gas mulia telah memiliki kulit valensi penuh, maka unsur tersebut tidak perlu memperoleh atau kehilangan elektron.
Konfigurasi gas mulia yang stabil ini disebabkan oleh konfigurasi elektroniknya.
Kulit elektron terluar dari unsur-unsur ini sudah penuh sehingga tidak perlu menambah atau mengurangi elektron.
Artinya mereka sangat tidak reaktif dan cenderung tidak membentuk ikatan kimia dengan unsur lain.
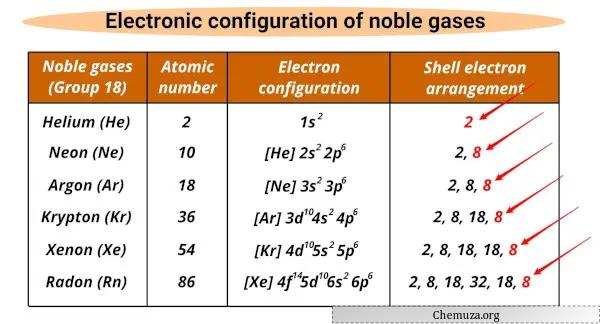
Daftar gas mulia dan konfigurasi elektronnya
Gas mulia dan konfigurasi elektroniknya ditunjukkan di bawah ini.
Apa kesamaan semua gas mulia?
Gas mulia mempunyai beberapa sifat yang sama .
Semuanya memiliki jumlah elektron valensi yang sama (8), kecuali helium yang memiliki 2.
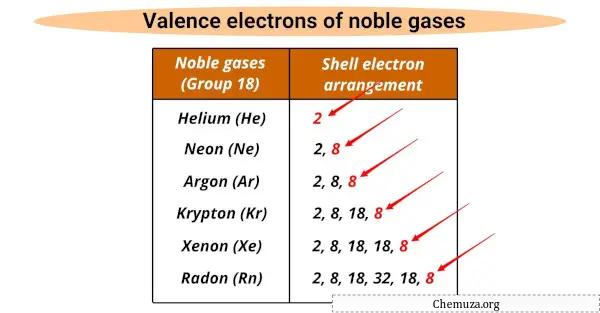
Elektron valensi adalah elektron terluar dalam atom yang berpartisipasi dalam reaksi kimia, dan gas mulia memiliki kulit valensi penuh sehingga tidak reaktif.
Selain itu, gas mulia adalah gas tidak berwarna yang tidak dapat kita lihat, juga tidak berbau , artinya tidak berbau. [3]
Terakhir, unsur-unsur tersebut ada secara alami sebagai gas monoatomik , artinya unsur-unsur tersebut hanya mempunyai satu atom dalam bentuk unsurnya.
Tidak seperti kebanyakan unsur lain yang cenderung membentuk molekul dengan berikatan dengan atom lain, gas mulia tidak perlu berikatan dengan atom lain karena gas mulia mempunyai kulit valensi yang penuh, sehingga sangat stabil dan tidak reaktif.
Ringkasan
Gas mulia adalah sekelompok unsur yang terdapat di kolom paling kanan tabel periodik, termasuk helium, neon, argon, kripton, xenon, dan radon.
Mereka dicirikan oleh reaktivitas yang rendah karena seluruhnya lapisan elektronik eksternal. Gas mulia bersifat inert atau non-reaktif karena mempunyai cangkang valensi penuh, sehingga sangat stabil dan tidak mungkin bereaksi dengan unsur lain.
Gas mulia memiliki sifat yang sama, termasuk jumlah elektron valensi yang sama (8 kecuali helium yang memiliki 2), gas tidak berwarna dan tidak berbau, dan secara alami terdapat sebagai gas monoatomik.
Mereka digunakan dalam berbagai aplikasi seperti penerangan, pengelasan dan kriogenik, serta pendingin dalam reaktor nuklir dan sebagai pengisi bola lampu pijar.
