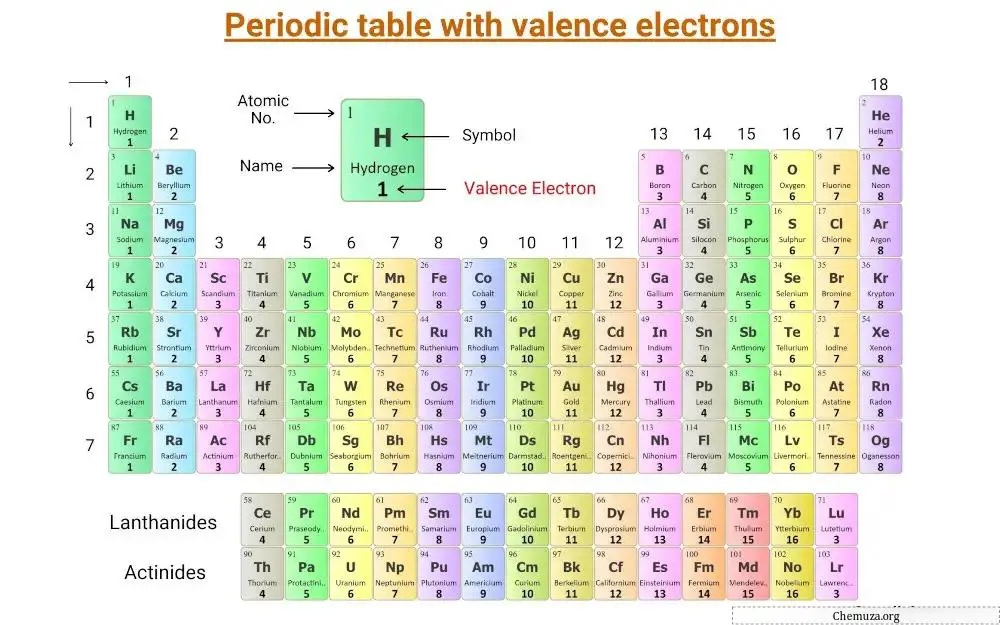
Ini adalah tabel periodik di mana elektron valensi diberi label.
Mari kita pahami konsep elektron valensi beserta jumlah elektron valensi unsur golongan utama dan unsur transisi .
Apa itu elektron valensi?
Elektron valensi adalah elektron yang terletak di kulit terluar atau tingkat energi suatu atom yang terlibat dalam ikatan kimia.
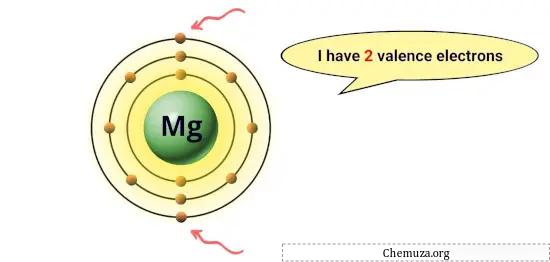
Misalnya magnesium mempunyai 2 elektron pada orbit terluarnya, sehingga mempunyai 2 elektron valensi. [1]
Elektron ini bertanggung jawab atas sifat kimia suatu unsur, seperti reaktivitasnya dan jenis ikatan kimia yang dapat dibentuknya dengan atom lain.
Jumlah elektron valensi suatu atom menentukan posisinya dalam tabel periodik dan kemampuannya membentuk ikatan kimia .
Elektron valensi unsur golongan utama
Unsur golongan utama, disebut juga unsur perwakilan, terletak pada golongan 1, 2, dan 13 hingga 18 pada tabel periodik.
Jumlah elektron valensi unsur-unsur tersebut sama dengan nomor golongannya.
Misalnya, unsur Golongan 1, seperti litium dan natrium , memiliki satu elektron valensi, sedangkan unsur Golongan 2, seperti magnesium dan kalsium , memiliki dua elektron valensi.
Unsur golongan 13, seperti boron dan aluminium , memiliki tiga elektron valensi, dan seterusnya.
Elektron valensi ini bertanggung jawab atas sifat kimia unik dan reaktivitas unsur.
Elektron valensi unsur transisi dan unsur transisi internal
Elektron valensi unsur transisi dan unsur transisi internal lebih rumit untuk ditentukan dibandingkan dengan unsur golongan utama.
Memang benar, sublapisan d dari elemen transisi dan sublapisan f dari elemen transisi internal tidak terisi lengkap dan sangat dekat dengan sublapisan luar s.
Akibatnya, elektron subkulit d dan s pada unsur transisi serta subkulit f dan s pada unsur transisi internal dapat berperilaku seperti elektron valensi.
Untuk unsur transisi, elektron valensi dapat berkisar antara 3 hingga 12 karena kontribusi elektron subkulit d dan subkulit s. Dalam beberapa kasus, elektron pada orbital d yang tidak lengkap juga dianggap sebagai elektron valensi. [2]
Demikian pula, untuk unsur transisi internal (atau unsur blok f), elektron valensi dapat berkisar antara 3 hingga 16 karena kontribusi elektron subkulit f dan subkulit s. [3] Elektron pada orbital d yang tidak lengkap juga dapat dianggap sebagai elektron valensi pada beberapa logam transisi internal.
Penting untuk diperhatikan bahwa untuk unsur transisi dan transisi internal, elektron valensi adalah elektron yang terdapat pada kulit di luar inti gas mulia.
