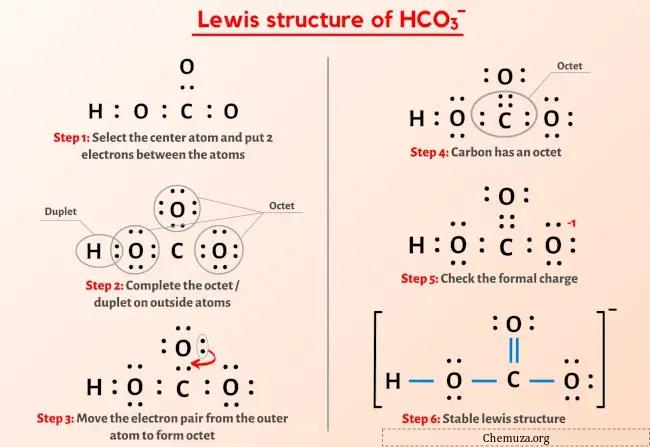
Jadi Anda sudah melihat gambar di atas kan?
Izinkan saya menjelaskan secara singkat gambar di atas.
Struktur HCO3-Lewis memiliki atom karbon (C) di tengahnya yang dikelilingi oleh dua atom oksigen (O) dan gugus OH. Terdapat 1 ikatan rangkap antara atom karbon (C) dan atom oksigen (O) dan atom lainnya mempunyai ikatan tunggal. Ada muatan formal -1 pada atom oksigen yang terikat tunggal (O).
Jika Anda tidak memahami apa pun dari gambar struktur HCO3-Lewis di atas, ikuti saja saya dan Anda akan mendapatkan penjelasan rinci langkah demi langkah tentang menggambar struktur Lewis ion HCO3-Lewis .
Jadi mari kita lanjutkan ke langkah-langkah menggambar struktur Lewis ion HCO3.
Langkah-langkah menggambar struktur HCO3-Lewis
Langkah 1: Temukan jumlah total elektron valensi dalam ion HCO3-
Untuk mengetahui jumlah total elektron valensi dalam ion HCO3, pertama-tama Anda perlu mengetahui elektron valensi yang ada pada atom hidrogen , atom karbon, dan juga atom oksigen.
(Elektron valensi adalah elektron yang ada di orbit terluar atom mana pun.)
Di sini saya akan memberi tahu Anda cara mudah mencari elektron valensi hidrogen, karbon, dan oksigen menggunakan tabel periodik.
Jumlah elektron valensi pada ion HCO3-
→ Elektron valensi diberikan oleh atom hidrogen:
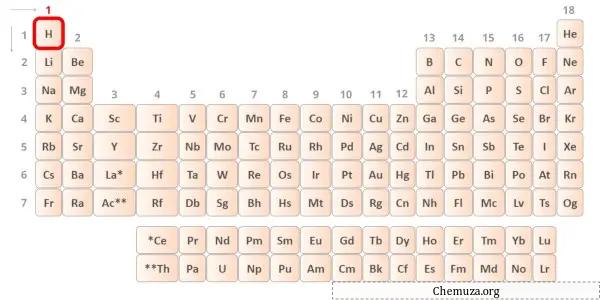
Hidrogen adalah unsur golongan 1 dalam tabel periodik. [1] Oleh karena itu, elektron valensi yang ada dalam hidrogen adalah 1 .

Anda dapat melihat bahwa hanya ada satu elektron valensi dalam atom hidrogen seperti yang ditunjukkan pada gambar di atas.
→ Elektron valensi diberikan oleh atom karbon:
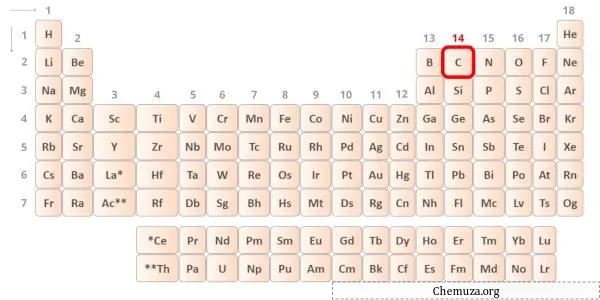
Karbon adalah unsur dalam golongan 14 tabel periodik. [2] Oleh karena itu, elektron valensi yang ada dalam karbon adalah 4 .
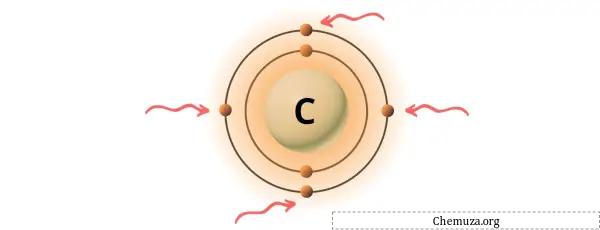
Anda dapat melihat 4 elektron valensi yang ada pada atom karbon seperti terlihat pada gambar di atas.
→ Elektron valensi diberikan oleh atom oksigen:

Oksigen adalah unsur dalam golongan 16 tabel periodik. [3] Oleh karena itu, elektron valensi yang ada dalam oksigen adalah 6 .
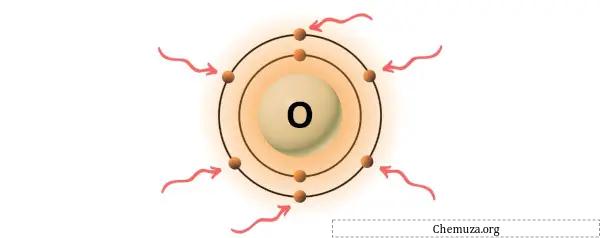
Anda dapat melihat 6 elektron valensi yang ada pada atom oksigen seperti terlihat pada gambar di atas.
Jadi,
Jumlah elektron valensi pada ion HCO3- = elektron valensi yang disumbangkan oleh 1 atom hidrogen + elektron valensi yang disumbangkan oleh 1 atom karbon + elektron valensi yang disumbangkan oleh 3 atom oksigen + 1 elektron tambahan yang ditambahkan karena 1 muatan negatif = 1 + 4 + 6 ( 3) + 1 = 24 .
Langkah 2: Pilih atom pusat
Untuk memilih atom pusat, kita harus ingat bahwa atom yang paling elektronegatifnya tetap berada di pusat.
(Ingat: jika ada hidrogen dalam molekul tertentu, selalu letakkan hidrogen di bagian luar.)
Sekarang molekul yang diberikan adalah HCO3- dan mengandung atom hidrogen (H), atom karbon (C) dan atom oksigen (O).
Jadi menurut aturan kita harus mencegah masuknya hidrogen.
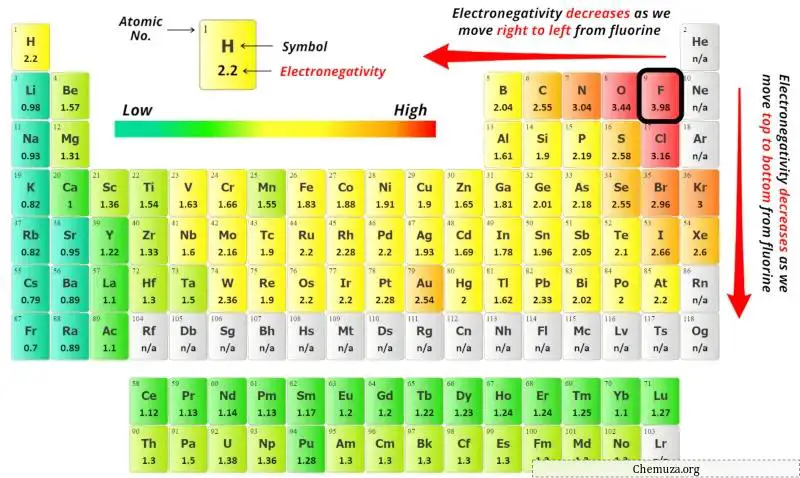
Sekarang Anda dapat melihat nilai keelektronegatifan atom karbon (C) dan atom oksigen (O) pada tabel periodik di atas.
Jika kita membandingkan nilai keelektronegatifan karbon (C) dan oksigen (O), maka atom karbon kurang elektronegatif .
Di sini, atom karbon (C) adalah atom pusat dan atom oksigen (O) adalah atom terluar.
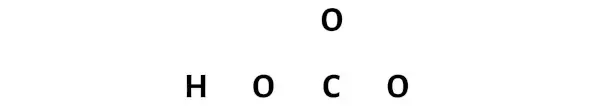
Langkah 3: Hubungkan setiap atom dengan menempatkan sepasang elektron di antara keduanya
Sekarang, dalam molekul HCO3, Anda perlu menempatkan pasangan elektron antara atom oksigen (O) dan hidrogen (H) dan antara atom oksigen (O) dan karbon (C).
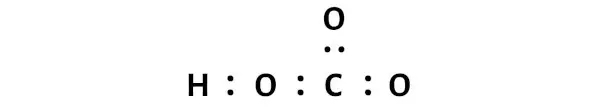
Hal ini menunjukkan bahwa atom-atom tersebut terikat secara kimia satu sama lain dalam molekul HCO3.
Langkah 4: Jadikan Atom Eksternal Stabil
Pada langkah ini Anda perlu memeriksa stabilitas atom luar.
Di sini, pada sketsa molekul HCO3 Anda dapat melihat bahwa atom terluarnya adalah atom hidrogen dan oksigen.
Atom hidrogen dan oksigen masing-masing membentuk duplet dan oktet sehingga stabil.
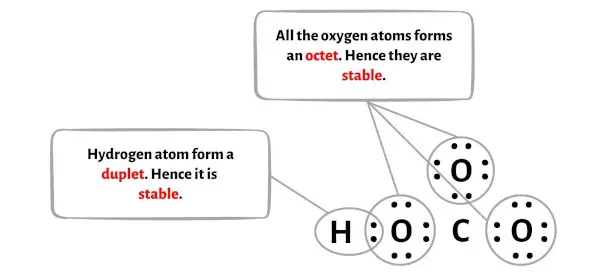
Selain itu, pada langkah 1, kami menghitung jumlah total elektron valensi yang ada dalam ion HCO3-.
Ion HCO3- memiliki total 24 elektron valensi dan semua elektron valensi ini digunakan pada diagram di atas.
Oleh karena itu, tidak ada lagi pasangan elektron yang dapat disimpan pada atom karbon pusat.
Jadi sekarang mari kita lanjutkan ke langkah berikutnya.
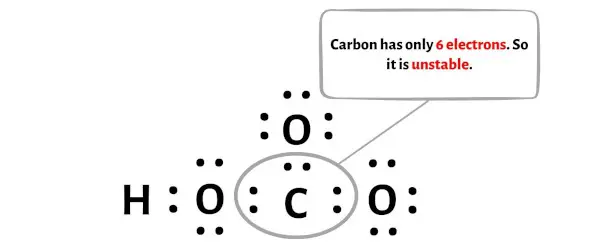
Langkah 5: Periksa oktet pada atom pusat. Jika tidak mempunyai oktet, pindahkan pasangan elektron bebasnya sehingga membentuk ikatan rangkap dua atau ikatan rangkap tiga.
Pada langkah ini, Anda perlu memeriksa apakah atom karbon pusat (C) stabil atau tidak.
Untuk memeriksa kestabilan atom karbon pusat (C), kita perlu memeriksa apakah atom tersebut membentuk oktet atau tidak.
Sayangnya, atom karbon tidak membentuk oktet di sini. Karbon hanya memiliki 6 elektron dan tidak stabil.
Nah, untuk membuat atom karbon ini stabil, Anda perlu menggeser pasangan elektron dari atom oksigen terluar agar atom karbon tersebut dapat memiliki 8 elektron (yaitu satu oktet).
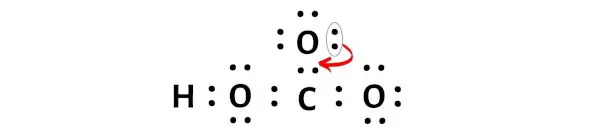
Setelah pasangan elektron ini berpindah, atom karbon pusat akan menerima 2 elektron lagi dan total elektronnya menjadi 8.
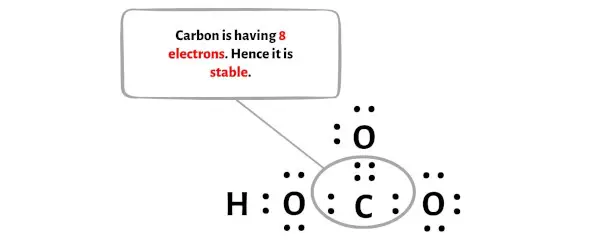
Terlihat pada gambar di atas bahwa atom karbon membentuk oktet karena memiliki 8 elektron.
Sekarang mari kita lanjutkan ke langkah terakhir untuk memeriksa apakah struktur Lewis di atas stabil atau tidak.
Langkah 6: Periksa stabilitas struktur Lewis
Sekarang Anda telah sampai pada langkah terakhir di mana Anda perlu memeriksa stabilitas struktur Lewis HCO3.
Stabilitas struktur Lewis dapat diverifikasi dengan menggunakan konsep muatan formal .
Singkatnya, sekarang kita harus mencari muatan formal pada atom hidrogen (H), karbon (C) dan oksigen (O) yang ada dalam molekul HCO3.
Untuk menghitung pajak formal, Anda harus menggunakan rumus berikut:
Muatan formal = Elektron valensi – (Elektron ikatan)/2 – Elektron non-ikatan
Jumlah elektron ikatan dan elektron non ikatan setiap atom molekul HCO3 dapat Anda lihat pada gambar di bawah ini.
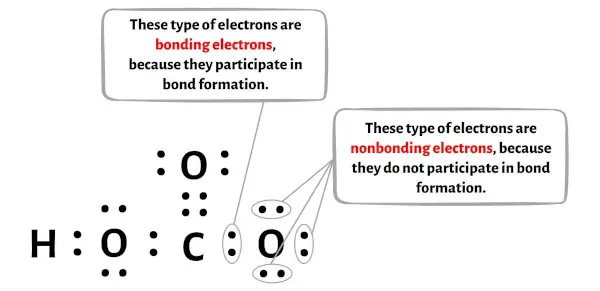
Untuk atom hidrogen (H):
Elektron valensi = 1 (karena hidrogen berada pada golongan 1)
Elektron ikatan = 2
Elektron tidak terikat = 0
Untuk atom karbon (C):
Elektron valensi = 4 (karena karbon berada pada golongan 14)
Elektron ikatan = 8
Elektron tidak terikat = 0
Untuk atom oksigen (O) yang terikat rangkap:
Elektron valensi = 6 (karena oksigen berada pada golongan 16)
Elektron ikatan = 4
Elektron tidak terikat = 4
Untuk atom oksigen (O) berikatan tunggal kiri:
Elektron valensi = 6 (karena oksigen berada pada golongan 16)
Elektron ikatan = 4
Elektron tidak terikat = 4
Untuk atom oksigen (O) yang lurus dan terikat tunggal:
Elektron valensi = 6 (karena oksigen berada pada golongan 16)
Elektron ikatan = 2
Elektron tidak terikat = 6
| Tuduhan formal | = | elektron valensi | – | (Mengikat elektron)/2 | – | Elektron yang tidak terikat | ||
| H | = | 1 | – | 2/2 | – | 0 | = | 0 |
| VS | = | 4 | – | 8/2 | – | 0 | = | 0 |
| O (lompatan ganda) | = | 6 | – | 4/2 | – | 4 | = | 0 |
| O (ikatan tunggal, kiri) | = | 6 | – | 4/2 | – | 4 | = | 0 |
| O (ikatan tunggal, kanan) | = | 6 | – | 2/2 | – | 6 | = | -1 |
Dari perhitungan muatan formal di atas, terlihat bahwa atom oksigen yang terikat tunggal (yang ada di sebelah kanan) mempunyai muatan -1 dan atom lainnya mempunyai muatan 0 .
Jadi mari kita pertahankan muatan ini pada masing-masing atom dalam molekul HCO3.
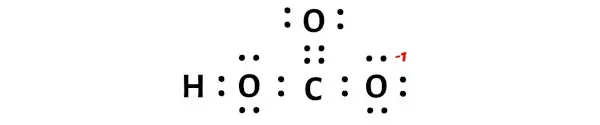
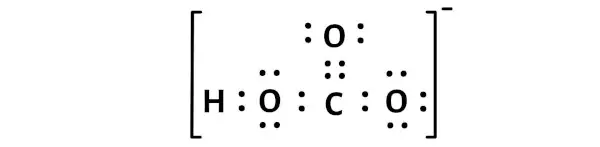
Muatan -1 keseluruhan pada molekul HCO3 ditunjukkan pada gambar di bawah.
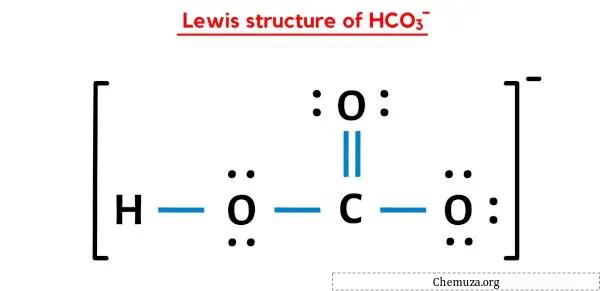
Dalam struktur titik Lewis ion HCO3 di atas, Anda juga dapat menyatakan setiap pasangan elektron ikatan (:) sebagai ikatan tunggal (|). Melakukannya akan menghasilkan struktur Lewis ion HCO3 berikut.
Saya harap Anda telah memahami sepenuhnya semua langkah di atas.
Untuk lebih banyak latihan dan pemahaman yang lebih baik, Anda dapat mencoba struktur Lewis lainnya yang tercantum di bawah.
Cobalah (atau setidaknya lihat) struktur Lewis ini untuk pemahaman yang lebih baik:
