Seng fluorida (ZnF2) adalah senyawa kimia. Itu terdiri dari seng dan fluor. Ini digunakan di berbagai industri seperti gigi dan elektronik karena sifatnya yang unik.
| Nama IUPAC | Seng fluorida |
| Formula molekul | ZnF2 |
| nomor CAS | 7783-49-5 |
| Sinonim | Seng difluorida, seng(II) fluorida |
| Di ChI | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Sifat seng fluorida
Formula Seng Fluorida
Rumus kimia seng difluorida adalah ZnF2. Rumus ini berarti setiap molekul seng difluorida terdiri dari satu atom seng (Zn) dan dua atom fluor (F).
Massa Molar Seng Fluorida
Massa molar seng difluorida (ZnF2) kira-kira 103,38 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom seng dan dua atom fluor.
Titik didih seng fluorida
Seng difluorida memiliki titik didih sekitar 872°C (1602°F). Ini adalah suhu di mana senyawa berubah dari cair menjadi gas di bawah tekanan atmosfer standar.
Seng fluorida Titik lebur
Titik leleh seng difluorida kira-kira 872°C (1602°F). Pada suhu ini, bentuk padat seng difluorida berubah menjadi cair.
Kepadatan seng fluorida g/mL
Kepadatan seng difluorida kira-kira 4,95 g/mL. Nilai ini mewakili massa senyawa per satuan volume dan menunjukkan beratnya.
Berat Molekul Seng Fluorida
Berat molekul seng difluorida (ZnF2) kira-kira 103,38 g/mol. Nilai ini mewakili jumlah berat atom seluruh atom dalam suatu molekul senyawa.
Struktur seng fluorida
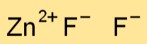
Seng difluorida (ZnF2) memiliki struktur kristal dimana setiap atom seng dikelilingi oleh empat ion fluorida yang tersusun dalam susunan tetrahedral. Susunan ini berkontribusi terhadap stabilitas senyawa.
Kelarutan seng fluorida
Seng difluorida menunjukkan kelarutan yang terbatas dalam air. Senyawa ini sulit larut, artinya hanya sejumlah kecil senyawa yang dapat larut dalam air untuk membentuk larutan. Karakteristik ini penting untuk berbagai aplikasi industri dan proses kimia.
| Penampilan | Padatan putih |
| Berat jenis | 4,95 gram/cm³ |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 103,38 g/mol |
| Kepadatan | 4,95 gram/ml |
| Titik fusi | 872°C (1602°F) |
| Titik didih | 872°C (1602°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Kelarutan terbatas |
| Kelarutan | Sulit larut, hanya sedikit yang dapat larut dalam air |
| Tekanan uap | Tidak terdefinisi dengan baik |
| Kepadatan uap | Tidak terdefinisi dengan baik |
| pKa | Tak dapat diterapkan |
| pH | Netral |
Keamanan dan bahaya seng fluorida
Seng difluorida (ZnF2) menimbulkan pertimbangan keamanan tertentu. Penting untuk menangani senyawa ini dengan hati-hati. Hindari menghirup atau menelan, karena dapat menyebabkan iritasi pernafasan dan pencernaan. Saat bekerja dengan ZnF2, kenakan alat pelindung diri yang sesuai seperti sarung tangan dan kacamata pengaman untuk menghindari kontak dengan kulit dan mata. Jika terjadi kontak yang tidak disengaja, bilas area yang terkena dengan banyak air. Simpan seng difluorida jauh dari bahan yang tidak kompatibel dan sumber panas. Meskipun tidak terlalu beracun, sebaiknya ikuti prosedur penanganan yang benar dan pastikan ventilasi yang baik untuk meminimalkan potensi risiko yang terkait dengan penggunaannya.
| Simbol bahaya | Korosif, Iritasi, Beracun Akut |
| Deskripsi Keamanan | Tangani dengan hati-hati. Hindari menghirup dan menelan. Kenakan peralatan pelindung. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 28261900 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis seng fluorida
Seng difluorida dapat disintesis dengan berbagai metode. Pendekatan umum melibatkan reaksi antara seng oksida (ZnO) dan asam fluorida (HF) . Dalam metode ini, ZnO dicampur dengan HF, menghasilkan pembentukan seng difluorida dan air. Metode lain melibatkan reaksi antara seng karbonat (ZnCO3) dan asam fluorida. Seng karbonat bereaksi dengan HF menghasilkan seng difluorida, karbon dioksida, dan air.
Selain itu, seng difluorida juga dapat dibuat dengan mereaksikan logam seng dengan gas fluor (F2) pada suhu tinggi. Reaksi ini secara langsung menghasilkan seng difluorida dengan pelepasan panas.
Selain itu, metode pengendapan dapat digunakan, di mana garam seng yang larut bereaksi dengan garam fluorida yang larut untuk membentuk seng difluorida yang tidak larut, yang kemudian dapat dipisahkan dan dikumpulkan.
Penting untuk berhati-hati selama proses sintesis ini karena reaktivitas bahan kimia yang terlibat. Tindakan dan peralatan keselamatan yang tepat harus digunakan untuk memastikan sintesis seng difluorida berhasil dan aman.
Kegunaan Seng Fluorida
Seng difluorida (ZnF2) dapat digunakan secara serbaguna di berbagai industri karena sifatnya yang unik. Berikut kegunaan utamanya:
- Perawatan Gigi: Memperkuat email gigi dan meningkatkan kebersihan mulut dengan memasukkan ZnF2 ke dalam formulasi pasta gigi.
- Optik dan Pelapis: Meningkatkan sifat anti-reflektif lensa dan meningkatkan transmisi cahaya dengan menggunakan ZnF2 dalam pelapis optik.
- Elektronik: Integrasikan ZnF2 ke dalam tampilan transistor film tipis (TFT) untuk membuat film konduktif transparan.
- Sumber Ion Fluorida: Gunakan ZnF2 sebagai sumber ion fluorida dalam sel elektrolitik untuk membantu menghasilkan logam reaktif seperti aluminium.
- Sintesis kimia: Gunakan ZnF2 sebagai katalis dan zat fluorinasi dalam berbagai reaksi kimia untuk memfasilitasi sintesis obat-obatan dan bahan kimia pertanian.
- Galvanisasi: Aplikasikan ZnF2 dalam proses finishing logam pada permukaan logam yang siap digalvanis, sehingga meningkatkan daya rekat dan daya tahan.
- Jendela Inframerah: Membuat jendela sensor inframerah dan sistem pencitraan termal menggunakan ZnF2 karena transparansinya di wilayah inframerah.
- Aplikasi laser: Gunakan ZnF2 sebagai media penguatan laser untuk berkontribusi pada pengembangan laser merdu untuk tujuan ilmiah dan industri.
- Pertumbuhan Kristal: Memasukkan ZnF2 ke dalam proses pertumbuhan kristal untuk semikonduktor dan komponen elektronik lainnya.
- Penelitian Kimia: Gunakan ZnF2 sebagai reaktan dan reaktan dalam berbagai reaksi kimia skala laboratorium, sehingga memudahkan eksplorasi senyawa baru.
Aplikasi yang beragam ini menyoroti pentingnya seng difluorida dalam teknologi modern, manufaktur, dan penelitian ilmiah di berbagai bidang.
Pertanyaan:
T: Apa rumus kimia seng fluorida?
A: Rumus kimia seng difluorida adalah ZnF2.
T: Apa rumus seng(II) fluorida?
A: Rumus seng(II) difluorida adalah ZnF2.
Q: Apa rumus senyawa ionik yang terbentuk dari ion seng dan fluorida?
A: Rumus senyawa ionik yang terbentuk dari Zn+2 dan ion fluorida adalah ZnF2.
T: Apa yang bisa terjadi akibat kekurangan seng, yodium, atau fluorida?
J: Kekurangan Zn, yodium atau fluorida dapat menyebabkan berbagai masalah kesehatan, mempengaruhi metabolisme, fungsi tiroid dan kesehatan gigi.
T: Manakah dari berikut ini yang tidak memiliki RDA? A. besi B. seng c. yodium d. fluor
J: Fluorida tidak memiliki tunjangan diet yang direkomendasikan (RDA).
T: Bagaimana seng fluorida dapat mempengaruhi manusia?
J: Seng difluorida dapat menyerang manusia melalui konsumsi, penghirupan, atau kemungkinan kontak dengan kulit, yang mungkin menyebabkan iritasi atau keracunan.
T: Apakah ZnF2 bersifat ionik atau molekuler?
J: ZnF2 adalah senyawa ionik.
T: Mengapa ZnF2 dan bukan ZnF?
A: ZnF2 menunjukkan bahwa setiap atom Zn terikat pada dua ion F, sehingga membentuk stoikiometri yang benar.
Q: Apakah ZnF2 dan NaOH akan membentuk endapan?
A: Ya, ZnF2 dan NaOH dapat membentuk endapan putih seng hidroksida (Zn(OH)2).
T: Apakah ZnF2 larut?
J: ZnF2 sulit larut dalam air.
Q: Apa nama senyawa yang mempunyai rumus ZnF2?
A: Senyawa dengan rumus ZnF2 disebut seng difluorida.
Q: Ksp ZnF2 adalah 3,0 × 10⁻² pada 25°C. Apa itu ΔG°?
A: Nilai ΔG° dapat dihitung berdasarkan nilai Ksp dan suhu yang diberikan menggunakan persamaan termodinamika yang sesuai.
T: Apa itu ZnF2?
A: ZnF2 adalah rumus kimia seng difluorida, senyawa seng dan fluor.
Q: Berapa jumlah mol pada ZnF2?
J: Jumlah mol ZnF2 bergantung pada massa tertentu dan massa molar senyawa.
