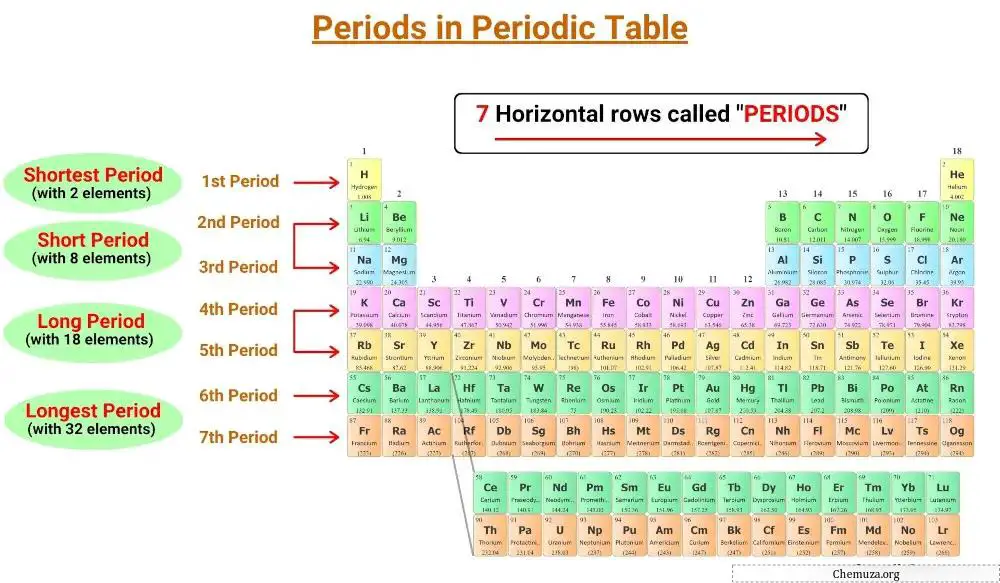
Garis mendatar pada tabel periodik disebut periode dan terdapat 7 periode dalam tabel periodik.
Unsur-unsur yang terletak pada periode yang sama mempunyai jumlah lapisan elektron yang sama.
Mari kita telusuri lebih jauh periode-periode pada tabel periodik.
Apa saja periode dalam tabel periodik?
Dalam tabel periodik, titik adalah garis yang memanjang secara horizontal dari kiri ke kanan.
Tabel periodik disusun sedemikian rupa sehingga unsur-unsur yang mempunyai sifat serupa dikelompokkan ke dalam kolom-kolom yang disebut golongan atau famili, sedangkan unsur-unsur dari periode yang sama mempunyai jumlah kulit elektron yang sama.
Ada tujuh periode dalam tabel periodik, bernomor 1 sampai 7. [1]
Jumlah kulit suatu unsur dan nomor periodenya
Jumlah kulit suatu unsur menentukan periodenya dalam tabel periodik.
Misalnya unsur periode 1 hanya mempunyai satu kulit elektron, sedangkan unsur periode 2 mempunyai dua kulit elektron, dan seterusnya.
Organisasi ini membantu ahli kimia memprediksi sifat suatu unsur berdasarkan lokasinya pada tabel periodik.
Ciri-ciri unsur dalam periode
Saat Anda menelusuri periode dalam tabel periodik, beberapa karakteristik unsur berubah dengan cara yang dapat diprediksi. Hal ini disebabkan oleh tren periodik yang diamati pada sifat-sifat unsur.
Jari-jari atom:
Saat Anda bergerak dari kiri ke kanan dalam satu periode, jari-jari atom umumnya mengecil. [2]
Hal ini disebabkan karena jumlah proton dalam inti bertambah sehingga menyebabkan gaya tarik menarik yang lebih besar antara inti dan elektron pada tingkat energi terluar. Hal ini menghasilkan jari-jari atom yang lebih kecil.
Keelektronegatifan:
Keelektronegatifan adalah ukuran kemampuan atom untuk menarik elektron ke dirinya sendiri dalam ikatan kimia.
Saat Anda berpindah dari kiri ke kanan selama satu periode, keelektronegatifan umumnya meningkat. [3]
Hal ini karena jari-jari atom lebih kecil dan muatan positif inti lebih kuat sehingga lebih menarik elektron bermuatan negatif.
Energi ionisasi:
Energi ionisasi adalah jumlah energi yang dibutuhkan untuk melepaskan elektron dari suatu atom.
Saat Anda bergerak dari kiri ke kanan selama satu periode, energi ionisasi umumnya meningkat. [4]
Hal ini karena jari-jari atom lebih kecil dan elektron terikat lebih erat pada inti sehingga lebih sulit melepaskan elektron.
Fitur lainnya:
Titik Leleh dan Titik Didih: Umumnya meningkat dari kiri ke kanan selama suatu periode, namun dengan beberapa pengecualian.
Sifat logam: menurun dari kiri ke kanan seiring berjalannya waktu, seiring dengan semakin banyaknya unsur non-logam .
Reaktivitas: Unsur-unsur menjadi kurang reaktif ketika bergerak dari kiri ke kanan dalam satu periode, karena elektron terikat lebih erat dan kecil kemungkinannya untuk berpartisipasi dalam reaksi kimia.
Pentingnya periode dalam kimia
Periode dalam tabel periodik sangat penting untuk memahami perilaku unsur karena memberikan informasi tentang konfigurasi elektronik suatu unsur dan bagaimana unsur tersebut berinteraksi dengan unsur lain. Berikut beberapa alasan mengapa periode penting dalam kimia:
- Memprediksi Sifat: Tabel periodik memungkinkan para ilmuwan memprediksi sifat unsur berdasarkan posisinya dalam tabel. Misalnya, unsur-unsur dari periode yang sama memiliki jumlah kulit elektron yang sama, sehingga dapat membantu memprediksi ukuran atom, reaktivitas, dan sifat lainnya.
- Identifikasi tren: Susunan unsur-unsur dalam tabel periodik memungkinkan para ilmuwan mengidentifikasi tren sifat-sifatnya. Misalnya, keelektronegatifan dan energi ionisasi cenderung meningkat dari kiri ke kanan dalam satu periode, sedangkan ukuran atom cenderung mengecil. Informasi ini dapat digunakan untuk membuat prediksi tentang perilaku unsur-unsur dalam reaksi kimia.
- Pengelompokan Unsur: Tabel periodik mengelompokkan unsur ke dalam kategori berdasarkan sifatnya, seperti logam, nonlogam, dan metaloid . Hal ini membantu para ilmuwan memahami persamaan dan perbedaan antara unsur-unsur dan bagaimana mereka berinteraksi satu sama lain.
- Menemukan unsur-unsur baru: Tabel periodik juga membantu para ilmuwan memprediksi keberadaan dan sifat-sifat unsur baru. Dengan memeriksa celah dalam tabel, para ilmuwan dapat memprediksi sifat-sifat unsur yang belum ditemukan dan menelitinya di laboratorium.
Ringkasan
Tabel periodik memiliki tujuh garis horizontal yang disebut periode. Unsur-unsur yang berasal dari periode yang sama mempunyai jumlah lapisan elektron yang sama. Ada tujuh periode dalam tabel periodik, bernomor 1 sampai 7, dan jumlah kulit suatu unsur menentukan periodenya.
Seiring berjalannya waktu dalam tabel periodik, jari-jari atom umumnya mengecil, sedangkan keelektronegatifan dan energi ionisasi umumnya meningkat. Karakteristik lain seperti titik leleh dan titik didih, karakter logam dan reaktivitas juga dapat diperkirakan berubah selama periode waktu tertentu.
Periode tabel periodik penting untuk memprediksi sifat-sifat unsur, mengidentifikasi tren, mengelompokkan unsur, dan menemukan unsur baru. Dengan memeriksa celah dalam tabel, para ilmuwan dapat memprediksi sifat-sifat unsur yang belum ditemukan dan menelitinya di laboratorium.
