Perak oksida (Ag2O) adalah senyawa kimia yang tersusun dari perak dan oksigen. Ini umumnya digunakan sebagai zat pengoksidasi dan katalis dalam berbagai reaksi kimia.
| Nama IUPAC | Perak(I) oksida |
| Formula molekul | Ag2O |
| nomor CAS | 11113-88-5 |
| Sinonim | Perak monoksida; Perak Oksida (1+); Dioksosilver; Perak oksida, di-perak; oksigen (2-) |
| Di ChI | InChI=1S/2Ag.O |
Sifat oksida perak
Rumus Perak Oksida
Rumus perak monoksida adalah Ag2O. Ini terdiri dari dua atom perak (Ag) yang terikat pada satu atom oksigen (O). Rumus ini mewakili rasio unsur-unsur yang ada dalam senyawa.
Massa Molar Perak Oksida
Massa molar perak monoksida dihitung dengan menjumlahkan massa atom unsur penyusunnya. Perak memiliki massa atom 107,87 g/mol dan oksigen memiliki massa atom 16,00 g/mol. Oleh karena itu, massa molar perak monoksida kira-kira 231,87 g/mol.
Titik didih oksida perak
Perak monoksida tidak memiliki titik didih yang jelas karena ia terurai sebelum mencapai titik didihnya. Ketika dipanaskan, ia mengalami reaksi kimia dan terurai menjadi logam perak dan gas oksigen.
Titik lebur oksida perak
Perak monoksida memiliki titik leleh sekitar 280°C (536°F). Pada suhu ini, perak monoksida padat berubah menjadi cair. Titik leleh menunjukkan suhu dimana wujud padat berubah menjadi wujud cair.
Kepadatan oksida perak g/mL
Massa jenis perak monoksida kira-kira 7,14 g/mL. Nilai ini mewakili massa senyawa per satuan volume. Kepadatan tinggi perak monoksida disebabkan oleh massa atom perak yang berat.
Berat Molekul Perak Oksida
Berat molekul perak monoksida dihitung dengan menjumlahkan massa atom unsur penyusunnya. Berat molekul Ag2O kira-kira 231,87 g/mol. Ini memberikan informasi tentang massa satu mol senyawa.
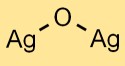
Struktur Perak Oksida
Perak monoksida memiliki struktur kristal. Atom perak dan oksigen tersusun dalam pola seperti kisi. Strukturnya terdiri dari kation Ag^+ dan anion O^2- yang disatukan oleh ikatan ionik.
Kelarutan oksida perak
Perak monoksida sulit larut dalam air. Ini larut sampai batas tertentu, menghasilkan perak hidroksida (AgOH). Kelarutan perak monoksida dapat ditingkatkan dengan menggunakan larutan asam atau basa, yang mengubahnya menjadi garam perak yang larut.
| Penampilan | Hitam pekat atau coklat tua |
| Berat jenis | 7,14 gram/cm³ |
| Warna | Hitam |
| Bau | Tidak berbau |
| Masa molar | 231,87 g/mol |
| Kepadatan | 7,14 gram/cm³ |
| Titik fusi | 280°C (536°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Larut dalam larutan asam atau basa |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Perak Oksida
Saat menangani perak monoksida, lakukan tindakan pencegahan untuk memastikan keselamatan Anda. Menelan atau menghirupnya mungkin berbahaya dan mengiritasi kulit, mata, dan sistem pernapasan. Pastikan ventilasi yang memadai untuk mencegah penumpukan debu atau asap. Kenakan peralatan pelindung seperti sarung tangan dan kacamata untuk meminimalkan kontak dengan senyawa. Simpan perak monoksida di tempat sejuk dan kering, jauh dari bahan mudah terbakar dan bahan yang tidak kompatibel. Jika tertelan, terhirup atau terkena kulit, segera dapatkan bantuan medis. Ikuti prosedur penanganan dan pembuangan yang benar untuk menghindari kontaminasi lingkungan.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Berbahaya jika tertelan atau terhirup. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2841.90.90 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas sedang |
Metode Sintesis Perak Oksida
Ada beberapa metode untuk mensintesis perak monoksida.
Pendekatan umum melibatkan reaksi antara garam perak yang larut, seperti perak nitrat (AgNO3) dan basa hidroksida, seperti natrium hidroksida (NaOH) . Reaksi berlangsung dengan mencampurkan larutan garam perak dan basa hidroksida, menghasilkan pembentukan endapan perak monoksida. Kumpulkan endapan dan keringkan untuk mendapatkan perak monoksida padat.
Metode lain melibatkan dekomposisi termal senyawa perak, seperti perak nitrat atau perak karbonat. Panaskan senyawa pada suhu tertentu untuk membentuk produk perak monoksida. Proses dekomposisi melepaskan nitrogen dioksida (NO2) atau karbon dioksida (CO2) tergantung pada senyawa awal yang digunakan.
Gunakan elektrolisis untuk mensintesis perak monoksida. Metode ini melibatkan melewatkan arus listrik melalui elektroda perak yang direndam dalam larutan elektrolit yang sesuai, sering kali mengandung perak nitrat. Terjadi oksidasi pada elektroda perak yang mengakibatkan terbentuknya perak monoksida pada permukaan elektroda.
Perlu dicatat bahwa pilihan metode sintesis bergantung pada faktor-faktor seperti kemurnian yang diinginkan, hasil, dan penerapan spesifik perak monoksida. Ikuti tindakan pencegahan keselamatan yang sesuai selama sintesis, termasuk menggunakan peralatan pelindung yang sesuai dan mengikuti prosedur yang direkomendasikan.
Kegunaan oksida perak
Perak monoksida memiliki berbagai kegunaan karena sifatnya yang unik. Berikut beberapa kegunaan perak monoksida:
- Zat pengoksidasi: Reaksi sintesis organik biasanya menggunakan perak monoksida sebagai zat pengoksidasi untuk mengubah alkohol menjadi aldehida atau keton.
- Katalis: Perak monoksida bertindak sebagai katalis dalam berbagai reaksi kimia, termasuk oksidasi alkena dan aldehida serta reduksi senyawa nitro.
- Baterai: Baterai kancing menggunakan perak monoksida sebagai bahan katoda karena kepadatan energi dan stabilitasnya yang tinggi.
- Agen Antimikroba: Perak monoksida menunjukkan sifat antimikroba, sehingga berguna dalam aplikasi seperti pembalut luka, peralatan medis, dan sistem pemurnian air.
- Pasta konduktif: Produksi produk elektronik, termasuk papan sirkuit cetak dan resistor film tebal, menggunakan perak monoksida dalam pasta konduktif.
- Industri Fotografi: Industri fotografi menggunakan perak monoksida karena sifatnya yang peka terhadap cahaya, khususnya dalam fotografi hitam putih.
- Kembang api: Campuran kembang api menggunakan perak monoksida untuk menghasilkan efek dan warna khusus pada kembang api.
- Reagen Kimia: Laboratorium menggunakan perak monoksida sebagai reagen kimia untuk berbagai prosedur analitis dan sintetik.
- Pembuatan kaca: Kacamata khusus, seperti pelapis cermin, menggunakan perak monoksida karena sifat reflektifnya.
- Pelapisan Perak: Aplikasi pelapisan perak terkadang menggunakan perak monoksida untuk menghasilkan lapisan yang tahan lama dan tahan korosi.
Berbagai penerapan ini menyoroti keserbagunaan dan pentingnya perak monoksida di berbagai industri.
Pertanyaan:
Q: Apakah Ag2O larut dalam air?
A: Ag2O sulit larut dalam air.
Q: Berapa gram Ag2O yang terurai jika 4,58 L O2 terbentuk pada P=745 mmHg dan T=308K?
A: Massa Ag2O yang terurai dapat dihitung dengan menggunakan stoikiometri dan hukum gas ideal.
T: Apakah Ag2O bersifat ionik?
A: Ya, Ag2O merupakan senyawa ionik.
T: Mengapa disebut oksida perak dan bukan oksida perak?
J: Konvensi penamaan senyawa ionik biner tidak menggunakan awalan seperti “di-“. Inilah sebabnya mengapa disebut oksida perak.
Q: Disakarida manakah yang tidak dapat bereaksi dengan Ag2O?
A: Ag2O tidak bereaksi dengan disakarida karena terutama digunakan sebagai zat pengoksidasi dalam sintesis organik.
T: Apa itu oksida perak?
A: Perak monoksida (Ag2O) adalah senyawa kimia yang tersusun dari perak dan oksigen, sering digunakan sebagai zat pengoksidasi dan katalis.
Q: Bisakah Alkaline dan Silver Oxide digunakan secara bergantian?
J: Alkaline dan perak oksida tidak dapat dipertukarkan karena mempunyai sifat kimia dan aplikasi yang berbeda.
Q: Berapa mol perak yang akan mengendap jika 0,632 mol timbal dioksidasi menjadi timbal(II) nitrat?
J: Stoikiometri persamaan seimbang akan menentukan jumlah mol perak yang diendapkan.
T: Berapa lama perak teroksidasi bertahan?
J: Berbagai faktor seperti kondisi lingkungan dan pemeliharaan menentukan umur panjang perak teroksidasi, namun perawatan yang tepat dapat mengawetkannya untuk jangka waktu yang lama.
