Nitrogen trifluorida atau NF3 adalah gas rumah kaca ampuh yang digunakan dalam industri elektronik untuk etsa dan pembersihan plasma. Ia memiliki umur atmosfer yang panjang dan berkontribusi terhadap perubahan iklim.
| Nama IUPAC | Nitrogen trifluorida |
| Formula molekul | NF3 |
| nomor CAS | 7783-54-2 |
| Sinonim | Trifluoramine, nitrogen fluorida (NF3), nitrogen fluorida (1:3), nitrogen fluorida (NF3), nitrogen (III) fluorida, nitrogen fluorida, tablet, UN 2451 |
| Di ChI | InChI=1S/F3N/c1-4(2)3 |
Massa Molar Nitrogen Trifluorida
Massa molar NF3 adalah 71,0 g/mol. Artinya satu mol NF3 mengandung 6.022 x 10^23 molekul.
Titik didih nitrogen trifluorida
NF3 memiliki titik didih -129,04°C atau -200,27°F. Jumlah ini relatif rendah dibandingkan gas lainnya, sehingga lebih mudah ditangani dalam aplikasi industri.
Nitrogen trifluorida Titik lebur
Nitrogen trifluorida memiliki titik leleh -206,73°C atau -340,11°F. Artinya pada suhu kamar, NF3 berbentuk gas.
Kepadatan NF3 g/mL
Massa jenis NF3 adalah 1,88 g/mL pada suhu dan tekanan standar. Artinya nitrogen trifluorida lebih padat dari udara dan akan tenggelam ke dalam tanah jika dilepaskan ke atmosfer.
Berat Molekul Nitrogen Trifluorida
Berat molekul NF3 adalah 71,0 g/mol. Ini adalah jumlah berat atom nitrogen dan fluor dalam senyawa.
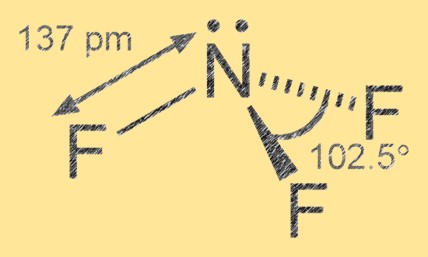
Struktur nitrogen trifluorida
Nitrogen trifluorida memiliki geometri molekul piramidal trigonal dengan nitrogen sebagai atom pusat dan tiga atom fluor yang mengelilinginya. Ikatan nitrogen-fluor bersifat kovalen polar, dengan atom fluor lebih elektronegatif dibandingkan nitrogen, menyebabkan muatan parsial negatif pada atom fluor dan muatan positif parsial pada atom nitrogen.
Formula Nitrogen Trifluorida
Rumus kimia nitrogen trifluorida adalah NF3, yang menunjukkan bahwa satu molekul NF3 mengandung satu atom nitrogen dan tiga atom fluor.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 2.62 |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 71,0 g/mol |
| Kepadatan | 1,88 g/mL pada STP |
| Titik fusi | -206,73°C atau -340,11°F |
| Titik didih | -129,04°C atau -200,27°F |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 0,41 g/100 mL pada 25°C |
| Kelarutan | Larut dalam pelarut organik |
| Tekanan uap | 315 kPa pada 20°C |
| Kepadatan uap | 2,01 (udara = 1) |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya nitrogen trifluorida
Nitrogen trifluorida (NF3) umumnya dianggap aman jika ditangani dengan benar, namun dapat menimbulkan beberapa bahaya jika tidak ditangani dengan benar. Ini dapat menyebabkan iritasi kulit dan mata, dan jika terhirup dalam konsentrasi tinggi dapat menyebabkan gangguan pernapasan. Gas NF3 dapat menggantikan oksigen di area yang berventilasi buruk, sehingga menyebabkan sesak napas. Ini juga merupakan gas rumah kaca yang berkontribusi terhadap perubahan iklim. Jika terjadi kebakaran, NF3 dapat melepaskan gas hidrogen fluorida beracun. Penting untuk mengikuti protokol keselamatan yang tepat, termasuk ventilasi yang memadai dan penggunaan peralatan pelindung, saat menangani NF3 untuk menghindari bahaya ini.
| Simbol bahaya | T, C |
| Deskripsi Keamanan | Hindari penghirupan dan kontak dengan kulit dan mata. Gunakan hanya di area yang berventilasi baik. |
| Nomor identifikasi PBB | UN2451 |
| kode HS | 28129090 |
| Kelas bahaya | 2.3 |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis nitrogen trifluorida
Ada beberapa metode untuk mensintesis nitrogen trifluorida (NF3):
Metode yang umum melibatkan reaksi amonia anhidrat (NH3) dengan gas fluor (F2) dengan adanya katalis seperti besi, nikel atau platinum. Reaksi tersebut menghasilkan NF3 dan hidrogen fluorida (HF). Industri biasanya menggunakan metode ini untuk produksi NF3.
Metode lain melibatkan dekomposisi termal amonium fluorida (NH4F) pada suhu tinggi. Reaksi tersebut menghasilkan NF3 dan gas amonia (NH3). Reaksi NH3 dengan F2 lebih efisien dibandingkan metode ini, sehingga kurang umum digunakan.
Metode lain melibatkan reaksi oksida nitrat (NO) dengan gas fluor dengan adanya katalis. Reaksi tersebut menghasilkan gas NF3 dan nitrogen dioksida (NO2).
NF3 juga dapat disintesis secara elektrokimia dengan melewatkan pelepasan listrik melalui campuran gas N2 dan F2. Plasma yang dihasilkan membentuk NF3 dan senyawa nitrogen-fluor lainnya.
Terlepas dari metode yang digunakan, sangat penting untuk menangani reagen yang sangat reaktif dan berpotensi berbahaya dengan tindakan pencegahan keselamatan yang tepat. Namun, peneliti harus mengontrol proses sintesis dengan hati-hati untuk memastikan hasil tinggi dan kemurnian produk akhir.
Kegunaan nitrogen trifluorida
Nitrogen trifluorida (NF3) memiliki berbagai aplikasi industri karena sifatnya yang unik.
- Industri semikonduktor menggunakan NF3 sebagai bahan pembersih wafer silikon. NF3 juga digunakan dalam produksi layar panel datar, sel surya, dan sistem mikroelektromekanis (MEMS).
- Pembuatan komponen elektronik menggunakan NF3 sebagai gas etsa plasma. Ini menunjukkan reaktivitas tinggi dan secara selektif menghilangkan bahan-bahan tertentu sementara membiarkan yang lain tetap utuh.
- Sistem pendingin juga menggunakan NF3 sebagai zat pendingin karena potensi pemanasan globalnya lebih rendah dibandingkan zat pendingin lainnya, sehingga menjadikannya pilihan yang lebih ramah lingkungan.
- Industri dirgantara menggunakan NF3 sebagai propelan karena impuls spesifiknya yang tinggi, yang memungkinkan penggerak pesawat ruang angkasa secara efisien.
Meskipun banyak kegunaannya, ada kekhawatiran mengenai dampak NF3 terhadap lingkungan. Ini adalah gas rumah kaca yang kuat dengan umur yang panjang di atmosfer. Produksi dan penggunaan NF3 dapat berkontribusi terhadap perubahan iklim jika tindakan pencegahan yang tepat tidak dilakukan. Inilah sebabnya mengapa upaya dilakukan untuk mengurangi penggunaannya dan mengembangkan alternatif yang lebih berkelanjutan.
Pertanyaan:
T: Apakah nitrogen trifluorida (NF3) bersifat polar?
J: Ya, NF3 bersifat polar. Ia memiliki geometri molekul piramidal trigonal, dengan atom nitrogen di tengah dan tiga atom fluor tersusun mengelilinginya. Bentuk molekul yang asimetris menyebabkan distribusi kerapatan elektron tidak merata sehingga menghasilkan molekul polar.
T: Apa rumus nitrogen trifluorida?
A: Rumus nitrogen trifluorida adalah NF3, yang menunjukkan bahwa molekul tersebut terdiri dari satu atom nitrogen dan tiga atom fluor.
T: Dari mana asal nitrogen trifluorida?
J: NF3 dapat diproduksi dengan berbagai metode, termasuk reaksi amonia anhidrat dengan gas fluor, dekomposisi termal amonium fluorida, dan sintesis elektrokimia. Ini umumnya digunakan dalam industri semikonduktor sebagai bahan pembersih dan dalam pembuatan komponen elektronik dan pendorong ruang angkasa.
Q: Struktur Lewis nitrogen trifluorida?
J: Struktur Lewis untuk NF3 terdiri dari atom nitrogen yang dihubungkan dengan tiga atom fluor melalui ikatan kovalen tunggal. Ada juga sepasang elektron non-ikatan pada atom nitrogen, sehingga molekul tersebut berbentuk piramida trigonal.
T: Gaya antarmolekul nitrogen trifluorida?
J: Gaya antarmolekul NF3 mencakup interaksi dipol-dipol, yang dihasilkan dari sifat polar molekul. Molekul tersebut juga bereksperimen dengan gaya dispersi London, yang merupakan gaya antarmolekul lemah yang diakibatkan oleh fluktuasi sementara dalam kerapatan elektron.
T: Apakah NF3 bersifat polar atau non-polar?
J: NF3 bersifat polar karena bentuknya yang asimetris dan distribusi kerapatan elektron yang tidak merata. Molekul tersebut memiliki momen dipol, yang menunjukkan bahwa ia memiliki ujung positif dan negatif, menjadikannya molekul polar.
