Nikel sulfat (NiSO4) adalah senyawa yang terdiri dari atom nikel, belerang, dan oksigen. Ini biasanya digunakan dalam pelapisan listrik, katalis dan sebagai nutrisi dalam beberapa pupuk.
| Nama IUPAC | Nikel(II) sulfat |
| Formula molekul | NiSO4 |
| nomor CAS | 7786-81-4 |
| Sinonim | Nikel sulfat, garam nikel dari asam sulfat, nikel (II) sulfat, nikel (2+); sulfat |
| Di ChI | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/jam;(H2,1,2,3,4)/q+2;/p-2 |
Sifat nikel sulfat
Formula nikel sulfat
Rumus kimia nikel sulfat adalah NiSO4. Ini mewakili kombinasi atom nikel (Ni) dan gugus sulfat (SO4). Rumusnya dengan jelas menunjukkan adanya nikel dan belerang, serta oksigen dalam gugus sulfat.
Massa Molar Nikel Sulfat
Massa molar nikel sulfat (NiSO4) dihitung dengan menjumlahkan massa atom unsur penyusunnya. Nikel (Ni) memiliki massa atom sekitar 58,69 gram per mol, sedangkan belerang (S) memiliki massa atom sekitar 32,07 gram per mol dan oksigen (O) memiliki massa atom sekitar 16 gram per mol. Dengan menambahkan nilai-nilai ini, massa molar nikel sulfat ditentukan menjadi sekitar 154,76 gram per mol.
Titik didih nikel sulfat
Nikel sulfat tidak memiliki titik didih tertentu karena terurai jika dipanaskan. Namun perlu diperhatikan bahwa suhu penguraiannya dipengaruhi oleh faktor-faktor seperti tekanan dan keberadaan zat lain. Oleh karena itu, disarankan untuk menangani nikel sulfat dengan hati-hati saat terkena suhu tinggi.
Titik lebur nikel sulfat
Titik leleh nikel sulfat adalah sekitar 100 derajat Celcius (212 derajat Fahrenheit). Pada suhu ini, bentuk padat nikel sulfat berubah menjadi cair. Perlu disebutkan bahwa variasi kemurnian dan struktur kristal nikel sulfat dapat sedikit mempengaruhi titik lelehnya.
Massa jenis nikel sulfat g/mL
Kepadatan nikel sulfat mengacu pada massa per satuan volume. Kepadatan nikel sulfat biasanya sekitar 3,68 gram per mililiter (g/mL). Perlu dicatat bahwa kepadatan dapat bervariasi tergantung pada suhu dan kemurnian sampel.
Berat Molekul Nikel Sulfat
Berat molekul nikel sulfat (NiSO4) merupakan penjumlahan dari berat atom unsur-unsur penyusunnya. Seperti disebutkan sebelumnya, berat molekul nikel sulfat kira-kira 154,76 gram per mol.
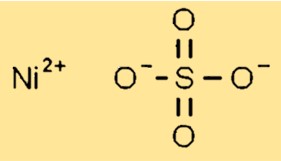
Struktur nikel sulfat
Nikel sulfat memiliki struktur kristal dalam keadaan padat. Ia membentuk kristal monoklinik dengan setiap ion nikel (Ni2+) dikelilingi oleh enam atom oksigen dari gugus sulfat. Gugus sulfat disusun sedemikian rupa untuk memungkinkan pemadatan kisi kristal yang efisien.
Kelarutan nikel sulfat
Nikel sulfat memiliki kelarutan sedang dalam air. Ia mudah larut dalam air, kelarutannya meningkat seiring dengan meningkatnya suhu. Kehadiran ion dan zat lain dapat mempengaruhi kelarutannya. Selain itu, nikel sulfat dapat membentuk hidrat bila digabungkan dengan molekul air, sehingga menghasilkan berbagai hidrat nikel sulfat.
| Penampilan | Kristal biru/hijau |
| Berat jenis | 3,68g/ml |
| Warna | Biru hijau |
| Bau | Tidak berbau |
| Masa molar | 154,76 g/mol |
| Kepadatan | 3,68g/ml |
| Titik fusi | 100°C (212°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air dan pelarut organik seperti etanol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | -1.1 (asam sulfat) |
| pH | Asam (sekitar 4) |
Keamanan dan Bahaya Nikel Sulfat
Nikel sulfat menimbulkan risiko keamanan tertentu yang perlu dipertimbangkan. Penting untuk menanganinya dengan hati-hati untuk menghindari potensi risiko. Kontak langsung dengan kulit harus diminimalkan, karena dapat menyebabkan iritasi atau sensitisasi kulit. Menelan atau menghirup nikel sulfat harus dihindari, karena dapat menyebabkan efek buruk pada kesehatan. Saat bekerja dengan nikel sulfat, peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai untuk menghindari kontak dengan bahan tersebut. Nikel sulfat harus disimpan di tempat sejuk dan kering, jauh dari bahan yang tidak kompatibel. Ventilasi yang memadai diperlukan saat bekerja dengan nikel sulfat untuk meminimalkan konsentrasi partikel di udara.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | – Hindari kontak dengan kulit – Hindari konsumsi dan inhalasi – Kenakan alat pelindung diri yang sesuai |
| Pengidentifikasi PBB | Tak dapat diterapkan |
| kode HS | 2833.25 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Dapat menyebabkan iritasi atau sensitisasi kulit |
Metode sintesis nikel sulfat
Ada berbagai metode untuk mensintesis nikel sulfat.
Pendekatan yang umum melibatkan reaksi antara logam nikel atau oksida nikel dengan asam sulfat . Dalam metode ini, asam sulfat melarutkan logam Ni atau oksida nikel, menghasilkan pembentukan nikel sulfat. Anda dapat melakukan reaksi dalam kondisi terkendali, seperti suhu dan pengadukan, untuk memastikan konversi yang efisien.
Metode lain melibatkan reaksi asam sulfat dengan nikel karbonat. Asam sulfat melarutkan nikel karbonat, menghasilkan nikel sulfat. Ahli kimia biasanya menggunakan metode ini ketika mereka memiliki nikel karbonat yang tersedia, karena metode ini menyediakan bahan awal yang mudah digunakan.
Selain itu, asam sulfat dapat melarutkan nikel hidroksida untuk mensintesis NiSO4. Pelarutan nikel hidroksida dalam asam sulfat menyebabkan terbentuknya NiSO4. Metode ini cocok bila seseorang ingin menggunakan nikel hidroksida sebagai prekursor untuk sintesis nikel sulfat.
Penting untuk dicatat bahwa Anda harus mengikuti tindakan pencegahan keselamatan yang tepat selama proses sintesis. Hal ini termasuk penggunaan peralatan pelindung dan prosedur penanganan yang tepat. Lakukan reaksi di area yang berventilasi baik untuk meminimalkan risiko paparan uap berbahaya. Kontrol yang cermat terhadap parameter reaksi, seperti suhu dan konsentrasi, sangat penting untuk memastikan konversi dan hasil nikel sulfat yang optimal.
Kegunaan Nikel Sulfat
Nikel sulfat memiliki berbagai aplikasi di berbagai industri. Berikut adalah beberapa kegunaan umum:
- Pelapisan listrik: Proses pelapisan listrik memanfaatkan nikel sulfat secara ekstensif untuk menciptakan lapisan yang tahan lama dan tahan korosi pada permukaan logam. Nikel sulfat meningkatkan penampilan, kekerasan, dan kekuatan barang-barang seperti perhiasan, suku cadang mobil, dan peralatan dapur.
- Katalis: Nikel sulfat bertindak sebagai katalis dalam banyak reaksi kimia, termasuk proses hidrogenasi dan oksidasi. Industri menggunakan katalis nikel sulfat dalam produksi obat-obatan, petrokimia, dan bahan kimia.
- Baterai: Baterai isi ulang, terutama baterai Ni-Cd dan Ni-MH, mengandung nikel sulfat sebagai komponen penting. Nikel sulfat memfasilitasi reaksi elektroda dan memastikan penyimpanan dan pelepasan energi listrik yang efisien.
- Pupuk: Beberapa pupuk menggunakan Ni larut dari nikel sulfat untuk menyediakan nutrisi penting bagi tanaman. Nikel memainkan peran penting dalam berbagai proses metabolisme pada tanaman, berkontribusi terhadap pertumbuhan dan perkembangannya.
- Tekstil: Industri tekstil menggunakan nikel sulfat dalam proses pewarnaan dan pencetakan untuk meningkatkan ketahanan luntur warna dan penyerapan pewarna pada kain. Nikel sulfat memastikan hasil warna yang cerah dan tahan lama.
- Farmasi: Nikel sulfat banyak digunakan dalam sediaan farmasi, terutama untuk memproduksi obat yang mengandung Ni sebagai bahan aktif atau untuk memformulasi kompleks Ni spesifik yang digunakan dalam penelitian medis.
- Penelitian dan pengembangan: Laboratorium menggunakan nikel sulfat untuk berbagai tujuan penelitian dan pengembangan, termasuk sintesis kimia, studi elektrokimia, dan penelitian ilmu material.
Pertanyaan:
Q: Apa rumus nikel(II) sulfat?
A: Rumus nikel(II) sulfat adalah NiSO4.
Q: Logam kromium ditambahkan ke dalam larutan nikel(II) sulfat. Apa yang dimaksud dengan reaksi kimia seimbang?
A: Reaksi kimia yang seimbang adalah: Cr + NiSO4 -> CrSO4 + Ni.
T: Bagaimana cara membuat nikel amonium sulfat?
A: Nikel amonium sulfat dapat dibuat dengan melarutkan nikel sulfat dan amonium sulfat dalam air, diikuti dengan kristalisasi.
T: Apakah nikel sulfat larut dalam air?
A: Ya, nikel sulfat larut dalam air.
T: Siapa yang mengekstraksi nikel sulfat?
J: Nikel sulfat tidak ditambang secara langsung. Bijih nikel ditambang dan nikel sulfat dapat diproduksi darinya.
Q: Apa nama senyawa NiSO4?
A: Senyawa NiSO4 disebut nikel sulfat.
Q: Berapa gram NiSO4 dalam 100 g hidrat? Berapa banyak tahi lalat?
A: Jumlah NiSO4 dalam 100 g hidrat bergantung pada spesifik senyawa hidrat dan massa molarnya.
Q: Apakah NiSO4 larut dalam air?
A: Ya, NiSO4 larut dalam air.
Q: Berapa gram NiSO4 yang diperoleh jika rendemennya 76,9%?
A: Gram NiSO4 yang diperoleh bergantung pada kuantitas awal dan kondisi reaksi.
T: Apakah NiSO4 berbahaya?
J: NiSO4 bisa berbahaya jika tidak ditangani dengan benar. Penting untuk mengikuti petunjuk keselamatan saat bekerja dengannya.
Q: Apa nama senyawa kovalen NiSO4?
J: NiSO4 bukan senyawa kovalen. Ini adalah senyawa ionik yang disebut nikel sulfat.
T: Apakah NiSO4 termasuk garam?
J: Ya, NiSO4 dianggap sebagai garam karena sifat ioniknya dan pembentukannya dari reaksi antara asam (asam sulfat) dan basa (nikel hidroksida).
T: Berapa muatan NiSO4?
A: Dalam NiSO4, ion nikel (Ni2+) membawa muatan positif 2+, sedangkan ion sulfat (SO4 2-) membawa muatan negatif 2-.
