Nikel(II) klorida, yang dikenal sebagai NiCl2, adalah senyawa kimia berwarna kuning kehijauan. Umumnya digunakan dalam pelapisan listrik, katalis, dan sebagai prekursor dalam sintesis senyawa nikel lainnya.
| Nama IUPAC | Nikel(II) klorida |
| Formula molekul | NiCl2 |
| nomor CAS | 7718-54-9 |
| Sinonim | Nikel klorida, nikel diklorida, diklorononikel, nikel klorida |
| Di ChI | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Sifat nikel klorida
Formula Nikel Klorida
Rumus nikel diklorida adalah NiCl2. Hal ini menunjukkan bahwa setiap molekul nikel diklorida terdiri dari satu atom nikel yang terikat pada dua atom klor. Rumus kimia ini memberikan informasi penting tentang komposisi dan perbandingan unsur-unsur yang ada dalam senyawa.
Massa Molar Nikel Klorida
Massa molar nikel diklorida, dihitung dengan menjumlahkan massa atom unsur penyusunnya, kira-kira 129,6 gram per mol. Nilai ini berguna untuk menentukan jumlah nikel diklorida yang ada dalam sampel tertentu dan untuk berbagai perhitungan stoikiometri.
Titik didih nikel klorida
Nikel diklorida memiliki titik didih sekitar 1,007 derajat Celsius (1,845 derajat Fahrenheit). Pada suhu ini, senyawa mengalami transisi fasa dari wujud cair ke wujud gas. Titik didih merupakan sifat fisik penting yang membantu memahami perilaku nikel diklorida saat dipanaskan.
Titik leleh nikel klorida
Titik leleh nikel diklorida kira-kira 1.002 derajat Celcius (1.836 derajat Fahrenheit). Ini adalah suhu di mana bentuk padat nikel diklorida berubah menjadi cair. Titik leleh penting untuk aplikasi yang melibatkan penanganan dan pengolahan nikel diklorida.
Massa jenis nikel klorida g/mL
Kepadatan nikel diklorida kira-kira 3,55 gram per mililiter. Massa jenis adalah ukuran massa per satuan volume suatu zat dan memberikan informasi tentang kekompakan suatu bahan. Kepadatan nikel diklorida membantu menentukan perilakunya dalam berbagai aplikasi dan kondisi fisik yang berbeda.
Berat Molekul Nikel Klorida
Berat molekul nikel diklorida kira-kira 129,6 gram per mol. Ini dihitung dengan menambahkan massa atom nikel dan klorin dalam senyawa. Berat molekul sangat penting untuk memahami hubungan antara massa, mol, dan jumlah partikel dalam reaksi kimia.
Struktur nikel klorida
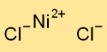
Nikel diklorida mengadopsi struktur kisi kristal dalam bentuk padatnya. Terdiri dari kation nikel (Ni2+) dan anion klorida (Cl-) yang tersusun bergantian. Susunan ini membentuk jaringan tiga dimensi yang berkontribusi terhadap stabilitas dan sifat fisik nikel diklorida.
Kelarutan nikel klorida
Nikel diklorida memiliki kelarutan sedang dalam air. Ini mungkin larut untuk membentuk larutan kuning kehijauan. Kelarutan nikel diklorida dipengaruhi oleh faktor-faktor seperti suhu dan keberadaan zat lain. Memahami kelarutannya penting dalam berbagai proses industri dan aplikasi kimia yang melibatkan nikel diklorida.
| Penampilan | Padatan berwarna kuning kehijauan |
| Berat jenis | 3,55g/ml |
| Warna | kuning kehijauan |
| Bau | Tidak berbau |
| Masa molar | 129,6 g/mol |
| Kepadatan | 3,55g/ml |
| Titik fusi | 1002°C (1836°F) |
| Titik didih | 1007°C (1845°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedang |
| Kelarutan | Larut dalam pelarut organik (etanol, aseton) dan asam |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Asam (sekitar 4) |
Keamanan dan Bahaya Nikel Klorida
Nikel diklorida menimbulkan risiko keamanan tertentu yang perlu dipertimbangkan. Penting untuk menangani senyawa ini dengan hati-hati untuk menghindari potensi risiko. Nikel diklorida dapat menyebabkan iritasi dan sensitisasi kulit, sehingga sarung tangan dan pakaian pelindung harus dipakai saat menanganinya. Menghirup debu atau uap nikel diklorida harus dihindari karena dapat menyebabkan iritasi pernafasan. Menelan nikel diklorida bisa berbahaya dan harus dihindari. Selain itu, nikel diklorida bersifat racun bagi kehidupan akuatik dan dapat menyebabkan kerusakan lingkungan jika dilepaskan ke badan air. Prosedur penyimpanan, penanganan dan pembuangan yang benar harus diikuti untuk meminimalkan risiko yang terkait dengan nikel diklorida.
| Simbol bahaya | Bahaya lingkungan yang korosif, berbahaya |
| Deskripsi Keamanan | – Kenakan sarung tangan dan pakaian pelindung – Hindari menghirup debu atau uap – Cegah tertelan – Simpan, tangani, dan buang dengan benar |
| Pengidentifikasi PBB | UN3288 |
| kode HS | 2827.39.80 |
| Kelas bahaya | 8 (Korosif) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Berbahaya jika tertelan, menyebabkan iritasi kulit dan mata |
Metode sintesis nikel klorida
Ada beberapa metode untuk mensintesis nikel diklorida, masing-masing memiliki kelebihan dan penerapannya sendiri.
Metode yang umum melibatkan reaksi logam nikel atau oksida nikel dengan asam klorida. Dalam proses ini, logam nikel atau nikel oksida ditambahkan ke wadah yang sesuai dan diaduk sambil menambahkan asam klorida secara perlahan. Reaksi antara nikel dan asam menghasilkan nikel diklorida serta pelepasan gas hidrogen.
Metode sintesis lain melibatkan reaksi antara nikel karbonat dan asam klorida. Asam klorida melarutkan nikel karbonat dan larutan yang dipanaskan mengalami reaksi membentuk nikel diklorida dan melepaskan gas karbon dioksida.
Asam klorida mengalami reaksi dengan nikel hidroksida terlarut ketika larutan dipanaskan atau didiamkan, menghasilkan sintesis nikel diklorida. Reaksi mengarah pada pembentukan nikel diklorida dan air.
Selain itu, nikel diklorida dapat dibuat dengan mereaksikan nikel logam dengan gas klor. Reaksi langsung antara kedua unsur ini menghasilkan nikel diklorida.
Metode sintesis ini menawarkan rute berbeda untuk memperoleh nikel diklorida, sehingga memungkinkan fleksibilitas dalam hal bahan mentah dan kondisi reaksi. Pilihan metode bergantung pada faktor-faktor seperti kemurnian produk akhir yang diinginkan, ketersediaan bahan mentah, dan persyaratan aplikasi spesifik.
Kegunaan Nikel Klorida
Nikel diklorida memiliki berbagai aplikasi di berbagai industri karena sifatnya yang unik. Berikut beberapa kegunaannya yang penting:
- Elektroplating: Proses elektroplating biasanya menggunakan nikel diklorida untuk memberikan lapisan pelindung dan dekoratif pada berbagai permukaan. Nikel diklorida meningkatkan penampilan logam seperti baja, kuningan dan tembaga sekaligus memberikan ketahanan terhadap korosi.
- Katalis: Nikel diklorida bertindak sebagai katalis dalam banyak reaksi kimia, termasuk proses hidrogenasi dan polimerisasi. Ini memfasilitasi konversi reaktan menjadi produk yang diinginkan dan diterapkan dalam produksi obat-obatan, plastik, dan serat sintetis.
- Sintesis kimia: Nikel diklorida berfungsi sebagai prekursor dalam sintesis berbagai senyawa nikel, seperti nikel oksida, nikel sulfida, dan nikel sianida. Industri menggunakan senyawa ini dalam katalis, pigmen, keramik, dan bahan magnetik.
- Baterai: Baterai isi ulang, khususnya baterai nikel-metal hidrida (NiMH), menggunakan nikel diklorida sebagai elektrolitnya. Hal ini memungkinkan sirkulasi ion antara elektroda selama siklus pengisian dan pengosongan.
- Pemurnian Gas: Industri menggunakan nikel diklorida dalam proses pemurnian gas untuk menghilangkan kotoran seperti hidrogen sulfida dan karbon monoksida. Ia menemukan aplikasi dalam penyulingan gas alam dan pengolahan petrokimia.
- Suplemen Pakan Ternak: Pakan ternak, khususnya pakan unggas dan babi, menggunakan nikel diklorida sebagai suplemen nutrisi. Ini memfasilitasi aktivitas enzim dan berkontribusi terhadap kesehatan dan pertumbuhan hewan secara keseluruhan.
- Penelitian Laboratorium: Para peneliti menggunakan nikel diklorida dalam berbagai percobaan laboratorium, termasuk dalam reaksi yang dikatalisis nikel dan sebagai sumber ion nikel untuk analisis kimia.
Penerapan yang beragam ini menunjukkan keserbagunaan dan pentingnya nikel diklorida di berbagai sektor mulai dari manufaktur dan energi hingga pertanian dan penelitian.
Pertanyaan:
Q: Ion apa saja yang ada dalam larutan NiCl2?
A: Dalam larutan NiCl2 berair, ion-ion yang ada adalah Ni2+ (kation nikel) dan Cl- (anion klorida).
Q: Apakah NiCl2 larut dalam air?
A: Ya, NiCl2 larut dalam air dan membentuk larutan berair berwarna kuning kehijauan.
Q: Logam manakah yang bereaksi secara spontan dengan NiCl2(aq)?
A: Logam seperti magnesium (Mg) dan seng (Zn) bereaksi secara spontan dengan NiCl2(aq) menggantikan nikel dan membentuk kloridanya masing-masing.
Q: Apakah NiCl2 polar atau non-polar?
J: NiCl2 merupakan senyawa polar karena perbedaan keelektronegatifan antara nikel dan klor, yang mengakibatkan distribusi muatan tidak merata.
Q: Apakah NiCl2 mengandung air?
J: Ya, NiCl2 dapat berada dalam keadaan berair ketika dilarutkan dalam air, membentuk larutan berair.
Q: Apa nama senyawa yang rumusnya NiCl2?
A: Senyawa dengan rumus NiCl2 disebut nikel(II) klorida.
Q: Bagaimana cara menyiapkan 1,00 L larutan NiCl2 0,50 M?
A: Untuk membuat larutan NiCl2 0,50 M, larutkan 129,6 gram NiCl2 dalam air dan buat volumenya menjadi 1,00 L.
Q: Berapakah garam tidak larut yang terbentuk antara larutan Na2S dan NiCl2?
A: Ketika larutan Na2S dicampur dengan NiCl2, terbentuklah nikel sulfida (NiS) yang tidak larut.
Q: Apakah NiCl2(aq) termasuk benda padat?
J: Tidak, NiCl2(aq) mengacu pada larutan NiCl2 dalam air, yang menunjukkan bahwa ia berbentuk cair.
T: Apa yang membuat kristal nikel(II) klorida berwarna hijau?
A: Warna hijau kristal nikel(II) klorida disebabkan oleh adanya kation nikel (Ni2+) dalam kisi kristal.
T: Apakah nikel diklorida beracun?
J: Ya, nikel diklorida beracun dan harus ditangani dengan hati-hati. Dapat menyebabkan iritasi kulit dan masalah pernapasan serta berbahaya jika tertelan.
T: Apakah reaksi terjadi jika larutan NiCl2 dan Na2S dalam air digabungkan?
J: Ya, reaksi terjadi ketika larutan NiCl2 dan Na2S dalam air digabungkan, menghasilkan pembentukan nikel sulfida (NiS) yang tidak larut dan natrium klorida (NaCl) yang larut.
Q: Berapa gram NiCl2 yang diperlukan untuk menetralkan 75,0 mL litium hidroksida 0,555 M?
A: Sekitar 18,4 gram NiCl2 diperlukan untuk menetralkan 75,0 ml litium hidroksida 0,555 M dalam reaksi stoikiometri.
T: Apa yang terjadi jika Anda mencampurkan amonium karbonat, nikel diklorida, dan air?
A: Ketika amonium karbonat, nikel diklorida dan air dicampur, terjadi reaksi yang menghasilkan pembentukan amonium klorida, nikel karbonat dan air.
