Nikel hidroksida (Ni(OH)2) adalah senyawa kimia yang tersusun dari ion nikel dan hidroksida. Ini biasanya digunakan sebagai pendahulu baterai berbasis nikel.
| Nama IUPAC | Nikel hidroksida |
| Formula molekul | Ni(OH)2 |
| nomor CAS | 12054-48-7 |
| Sinonim | Nikel(II) hidroksida; Nikel hidroksida; Nitrogen Nikel Trioksida (2+) |
| Di ChI | InChI=1S/Ni.2H2O/jam;2*1H2/q+2;;/p-2 |
Sifat nikel hidroksida
Formula Nikel Hidroksida
Rumus nikel hidroksida adalah Ni(OH)2. Terdiri dari satu ion nikel (Ni) dan dua ion hidroksida (OH-). Rumus kimia ini mewakili komposisi nikel hidroksida pada tingkat atom.
Massa Molar Nikel Hidroksida
Massa molar Ni(OH)2 dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Nikel memiliki massa atom 58,6934 g/mol dan setiap ion hidroksida memiliki massa 17,007 g/mol. Jika dijumlahkan, massa molar Ni(OH)2 kira-kira 92,6934 g/mol.
Titik didih nikel hidroksida
Ni(OH)2 tidak memiliki titik didih yang jelas karena terurai ketika dipanaskan. Pada suhu tinggi ia mengalami dekomposisi termal dan berubah menjadi nikel oksida (NiO) dan uap air.
Titik leleh nikel hidroksida
Titik leleh Ni(OH)2 kira-kira 230°C. Pada suhu ini, Ni(OH)2 mengalami perubahan fasa dari padat menjadi cair. Senyawa tersebut meleleh, memungkinkan terjadinya reaksi atau perawatan kimia lebih lanjut.
Massa jenis nikel hidroksida g/mL
Massa jenis Ni(OH)2 kira-kira 4,1 g/mL. Nilai ini mewakili massa senyawa per satuan volume. Ini menunjukkan kekompakan atau konsentrasi Ni(OH)2 dalam suatu ruang.
Berat Molekul Nikel Hidroksida
Berat molekul Ni(OH)2 ditentukan dengan menjumlahkan berat atom unsur penyusunnya. Nikel memiliki berat atom 58,6934 g/mol dan setiap ion hidroksida memiliki berat 17,007 g/mol. Jadi, berat molekul Ni(OH)2 kira-kira 92,6934 g/mol.
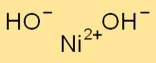
Struktur nikel hidroksida
Ni(OH)2 mengkristal dalam sistem kristal heksagonal. Ini membentuk lapisan ion Ni+2 dan OH- yang bertumpuk satu sama lain. Ion Ni+2 dikelilingi oleh ion OH- secara terkoordinasi, menciptakan struktur jaringan.
Kelarutan nikel hidroksida
Ni(OH)2 sulit larut dalam air. Ia larut sampai batas tertentu, membentuk larutan yang sedikit basa karena adanya ion hidroksida. Kelarutan Ni(OH)2 dapat dipengaruhi oleh beberapa faktor seperti suhu dan pH.
| Penampilan | Hijau solid |
| Berat jenis | 4.1g/ml |
| Warna | Hijau |
| Bau | Tidak berbau |
| Masa molar | 92,6934 g/mol |
| Kepadatan | 4.1g/ml |
| Titik fusi | 230°C |
| Titik didih | Terurai |
| Titik kilat | T/A |
| Kelarutan dalam air | Sedikit larut |
| Kelarutan | Tidak larut, membentuk larutan basa dalam air |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | T/A |
| pH | basa |
Keamanan dan Bahaya Nikel Hidroksida
Ni(OH)2 menimbulkan risiko keamanan tertentu yang harus dipertimbangkan. Ini dapat mengiritasi kulit, mata dan sistem pernafasan melalui kontak atau inhalasi. Paparan yang berkepanjangan atau berulang-ulang dapat menyebabkan sensitisasi, menyebabkan reaksi alergi. Penting untuk menangani Ni(OH)2 dengan hati-hati, menggunakan tindakan perlindungan yang sesuai seperti sarung tangan, kacamata pelindung, dan alat bantu pernapasan. Jika terjadi konsumsi atau paparan yang tidak disengaja, perhatian medis segera harus dicari. Selain itu, Ni(OH)2 dianggap sebagai bahaya lingkungan dan harus dibuang dengan benar sesuai peraturan untuk mencegah kontaminasi tanah atau sumber air.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | – Dapat menyebabkan iritasi kulit dan mata\n- Dapat menyebabkan iritasi pernafasan\n- Kemungkinan menyebabkan sensitisasi\n- Ikuti prosedur penanganan dan pembuangan yang benar |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2825.70.10 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Dianggap toksisitas rendah hingga sedang |
Harap diingat bahwa simbol bahaya dan tanda pengenal PBB tidak berlaku untuk Ni(OH)2 karena tidak diklasifikasikan sebagai bahan berbahaya. Deskripsi keselamatan yang diberikan menyoroti potensi risiko dan tindakan pencegahan yang terkait dengan penanganan Ni(OH)2. Toksisitas Ni(OH)2 umumnya dianggap rendah hingga sedang.
Metode sintesis nikel hidroksida
Ada beberapa metode sintetik yang tersedia untuk produksi Ni(OH)2. Metode yang umum melibatkan reaksi antara garam nikel yang larut, seperti nikel sulfat atau nikel nitrat, dan basa hidroksida, biasanya natrium hidroksida atau kalium hidroksida. Reaksi berlangsung dalam larutan air dalam kondisi terkendali, menghasilkan pembentukan Ni(OH)2 sebagai endapan.
Dalam metode deposisi elektrokimia, sel elektrolitik menggunakan logam nikel sebagai elektrodanya. Ini menerapkan arus listrik yang sesuai untuk mereduksi ion nikel dari elektrolit dan menyimpannya pada elektroda dalam bentuk Ni(OH)2. Metode ini memungkinkan kontrol yang tepat terhadap komposisi dan morfologi Ni(OH)2 yang dihasilkan.
Dekomposisi termal garam nikel memungkinkan produksi Ni(OH)2. Dengan memanaskan garam nikel, seperti nikel karbonat atau Ni(OH)2 itu sendiri, dalam lingkungan yang terkendali, senyawa tersebut mengalami dekomposisi, menghasilkan Ni(OH)2 serta produk sampingan lainnya.
Perlu disebutkan bahwa pilihan metode sintesis bergantung pada faktor-faktor seperti kemurnian yang diinginkan, ukuran partikel, dan persyaratan aplikasi spesifik. Ketika memilih rute sintetik yang tepat untuk produksi Ni(OH)2, kita harus hati-hati mempertimbangkan hasil yang diinginkan karena kelebihan dan keterbatasan yang terkait dengan masing-masing metode.
Kegunaan Nikel Hidroksida
Ni(OH)2 dapat digunakan dalam berbagai aplikasi karena sifatnya yang unik. Berikut beberapa kegunaan umum Ni(OH)2:
- Pembuatan baterai: Ni(OH)2 memainkan peran penting sebagai bahan katoda dalam baterai berbasis nikel, seperti baterai nikel-kadmium (NiCd) dan nikel-metal hidrida (NiMH). Ia menyimpan dan melepaskan energi listrik, memungkinkan penyimpanan energi yang efisien.
- Katalis: Ni(OH)2 bertindak sebagai katalis dalam berbagai reaksi kimia, termasuk proses hidrogenasi dan oksidasi. Sifat katalitiknya memfasilitasi konversi reaktan yang efisien menjadi produk yang diinginkan.
- Pelapisan listrik: Ni(OH)2 membentuk lapisan nikel yang stabil dan melekat, menjadikannya berharga dalam aplikasi pelapisan listrik. Ini memberikan lapisan pelindung, tahan korosi dan menarik secara estetika pada berbagai permukaan logam.
- Pigmen: Produsen menggunakan Ni(OH)2 sebagai pigmen hijau dalam produksi keramik, kaca, dan plastik. Warnanya yang hijau cerah meningkatkan nilai estetika material tersebut.
- Sensor gas: Sensor berbasis Ni(OH)2 mendeteksi dan memantau gas seperti hidrogen, amonia, dan hidrogen sulfida. Perubahan konduktivitas listrik pada film Ni(OH)2 memungkinkan pendeteksian gas-gas ini secara efisien.
- Pengolahan Air: Ni(OH)2 membantu proses pengolahan air dengan secara selektif menyerap dan menghilangkan kontaminan logam berat, seperti timbal dan kadmium. Ia menunjukkan afinitas terhadap logam-logam ini, sehingga berguna untuk menghilangkannya dari sumber air.
- Aplikasi farmasi: Ni(OH)2 dapat diaplikasikan dalam formulasi farmasi, berfungsi sebagai pengikat, penghancur atau pengatur pH dalam formulasi tablet atau kapsul.
Ini hanyalah beberapa contoh dari berbagai penerapan Ni(OH)2, yang menunjukkan keserbagunaan dan pentingnya Ni(OH)2 dalam berbagai industri.
Pertanyaan:
T: Apa rumus kimia nikel(II) hidroksida basa?
A: Rumus kimia nikel(II) hidroksida adalah Ni(OH)2.
T: Apakah nikel hidroksida larut dalam air?
Jawaban: Ni(OH)2 tidak larut dalam air.
Q: Berapa gram nikel(II) klorida yang diperlukan untuk menetralkan 75,0 ml litium hidroksida 0,555 M?
A: Gram nikel klorida yang dibutuhkan dapat dihitung menggunakan stoikiometri dan molaritas larutan litium hidroksida.
Q: Berapakah muatan yang diwakili oleh Ni(OH)2?
A: Muatan Ni(OH)2 bersifat netral atau nol.
Q: Bagaimana cara menghitung kelarutan molar Ni(OH)2?
A: Kelarutan molar Ni(OH)2 dapat ditentukan dengan membagi jumlah mol senyawa terlarut dengan volume larutan.
Q: Bagaimana bentuk persamaan setara NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)?
A: Persamaan setaranya adalah 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
Q: Berapa gram per mol Ni(OH)2?
J: Massa molar Ni(OH)2 kira-kira 92,6934 g/mol.
Q: Apakah Ni(OH)2 larut dalam air?
J: Tidak, Ni(OH)2 tidak larut dalam air.
Q: Apa zat pereduksi pada reaksi ini: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
A: Zat pereduksi dalam reaksi ini adalah magnesium (Mg).
Q: Apakah Ni(OH)2 termasuk benda padat?
J: Ya, Ni(OH)2 adalah senyawa padat.
Q: Jika sel mempunyai potensial 0,247 V pada suhu 25°C, berapakah Ksp Ni(OH)2?
A: Ksp Ni(OH)2 dapat ditentukan menggunakan persamaan Nernst dan potensial sel.
Q: Garam manakah yang lebih larut dalam larutan asam dibandingkan dalam air murni?
A: Garam seperti Ni(OH)2 akan lebih larut dalam larutan asam karena reaksi netralisasi dengan asam.
