Natrium sulfit, juga dikenal sebagai Na2SO3, adalah bubuk kristal putih yang biasa digunakan sebagai pengawet dalam industri makanan dan sebagai zat pereduksi dalam fotografi.
| Nama IUPAC | Dinatrium sulfit |
| Formula molekul | Na2SO3 |
| nomor CAS | 7757-83-7 |
| Sinonim | Natrium sulfit; Dinatrium sulfit; Asam sulfat, garam dinatrium; Natrium sulfonat; Natrium Sulfit |
| Di ChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/jam;;(H2,1,2,3)/q2*+1;/p-2 |
Sifat natrium sulfit
Rumus Natrium Sulfit
Rumus kimia natrium sulfit adalah Na2SO3. Ini terdiri dari dua ion Na+ dan satu ion SO32-. Ion Na+ bermuatan positif sedangkan ion SO32- bermuatan negatif. Natrium sulfit adalah senyawa ionik yang membentuk bubuk kristal putih.
Massa Molar Natrium Sulfit
Massa molar Na2SO3 adalah 126,04 g/mol. Nilai ini diperoleh dengan menjumlahkan massa atom setiap unsur dalam senyawa. Massa atom natrium, belerang, dan oksigen berturut-turut adalah 22,99 g/mol, 32,06 g/mol, dan 15,99 g/mol. Massa molar merupakan parameter penting yang digunakan dalam perhitungan stoikiometri dan juga dapat digunakan untuk menentukan jumlah zat yang ada dalam suatu sampel.
Titik didih natrium sulfit
Na2SO3 memiliki titik didih yang relatif tinggi yaitu 1650°C. Hal ini disebabkan kuatnya ikatan ion antara ion Na+ dan SO32- sehingga memerlukan energi yang besar untuk memutuskannya. Titik didih adalah suhu di mana suatu zat berubah dari fase cair menjadi fase gas. Pada suhu ini, tekanan uap zat cair sama dengan tekanan atmosfer.
Titik Leleh Natrium Sulfit
Titik leleh Na2SO3 adalah 33,4°C. Titik leleh yang relatif rendah ini disebabkan lemahnya gaya antarmolekul antar molekul Na2SO3. Ketika dipanaskan, gaya antarmolekul diatasi dan padatan Na2SO3 meleleh menjadi cairan.
Massa jenis natrium sulfit g/mL
Massa jenis Na2SO3 adalah 2,633 g/mL. Massa jenis didefinisikan sebagai massa suatu zat per satuan volume. Kepadatan Na2SO3 yang tinggi disebabkan oleh sifat ioniknya dan adanya dua ion natrium per ion sulfit dalam strukturnya.
Berat Molekul Natrium Sulfit
Berat molekul Na2SO3 adalah 126,04 g/mol. Nilai ini diperoleh dengan menjumlahkan berat atom setiap unsur dalam senyawa. Berat molekul merupakan parameter penting yang digunakan dalam perhitungan stoikiometri dan juga dapat digunakan untuk menentukan jumlah zat yang ada dalam suatu sampel.
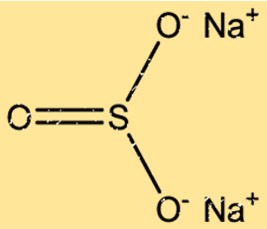
Struktur natrium sulfit
Na2SO3 memiliki struktur kristal dengan dua ion Na+ dan satu ion SO32- yang tersusun dalam pola berulang. Ion Na+ tersusun dalam kisi kubik berpusat muka, sedangkan ion SO32- menempati lokasi oktahedral kisi tersebut. Ikatan ionik antara ion Na+ dan SO32- menghasilkan struktur kristal yang stabil.
Kelarutan natrium sulfit
Na2SO3 sangat larut dalam air, dengan kelarutan 22,4 g/100 mL pada 20°C. Kelarutan yang tinggi ini disebabkan oleh sifat ionik Na2SO3 yang memungkinkannya berdisosiasi dalam air dan membentuk ion Na+ dan SO32-. Kelarutan Na2SO3 dalam air meningkat seiring dengan peningkatan suhu, seiring dengan peningkatan energi kinetik molekul dan semakin banyak ion yang dilepaskan ke dalam larutan.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 2,633 gram/cm³ |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 126,04 g/mol |
| Kepadatan | 2,633 gram/mL |
| Titik fusi | 33,4°C |
| Titik didih | 1650°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam gliserol, sedikit larut dalam etanol |
| Tekanan uap | 0 mmHg pada 20°C |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 06:35 |
| pH | 8.3 – 9.5 (larutan 5%) |
Keamanan dan Bahaya Natrium Sulfit
Na2SO3 bisa berbahaya jika tidak ditangani dengan benar. Ini dapat menyebabkan iritasi kulit dan mata dan, jika tertelan, dapat menyebabkan mual, muntah dan sakit perut. Ini juga dapat menyebabkan iritasi pernafasan jika terhirup. Selain itu, Na2SO3 dapat bereaksi dengan bahan kimia lain menghasilkan gas beracun, seperti sulfur dioksida, yang dapat membahayakan kesehatan Anda. Oleh karena itu, penting untuk memakai alat pelindung diri yang sesuai saat menangani Na2SO3 dan menghindari paparan pada mata, kulit, dan selaput lendir. Na2SO3 juga harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Xi, O |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata. Jika terjadi kontak, segera bilas dengan banyak air dan konsultasikan dengan dokter. Jangan menelan. Hindari menghirup debu. Kenakan alat pelindung diri yang sesuai. Jauhkan dari panas, percikan api dan nyala api. |
| ID | 1384 |
| kode HS | 283210 |
| Kelas bahaya | 8 – Zat korosif |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (oral, tikus) – 1,640 mg/kg; LC50 (inhalasi, tikus) – 63 mg/m³ |
Metode sintesis natrium sulfit
Berbagai metode dapat mensintesis Na2SO3.
Metode yang umum adalah mereaksikan natrium hidroksida dengan gas sulfur dioksida dengan adanya air. Reaksi tersebut menghasilkan Na2SO3 dan air sebagai produk sampingan.
Dalam metode lain, natrium karbonat bereaksi dengan gas sulfur dioksida dengan adanya air, menghasilkan gas Na2SO3 dan karbon dioksida. Untuk meningkatkan rendemen Na2SO3, reaksi ini dapat dilakukan pada suhu dan tekanan tinggi.
Reaksi natrium bisulfit dengan natrium hidroksida dapat mensintesis Na2SO3. Reaksi ini menghasilkan Na2SO3, air dan natrium klorida sebagai produk sampingan.
Metode lain melibatkan reaksi natrium sulfida dengan gas sulfur dioksida dengan adanya air untuk menghasilkan gas Na2SO3 dan hidrogen sulfida.
Untuk mensintesis Na2SO3, natrium sulfat harus diolah dengan gas sulfur dioksida dengan adanya zat pereduksi, seperti karbon aktif. Reaksi ini menghasilkan Na2SO3 dan karbon dioksida.
Masing-masing metode ini memiliki kelebihan dan kekurangannya masing-masing, dan pemilihan metode bergantung pada berbagai faktor, seperti hasil yang diinginkan, kemurnian dan biaya produk, serta ketersediaan reagen dan peralatan.
Kegunaan natrium sulfit
Na2SO3 memiliki beberapa kegunaan industri dan komersial yang penting, termasuk:
- Fotografi: Digunakan sebagai zat pereduksi dan pengawet dalam solusi pengembangan fotografi. Ini membantu menstabilkan gambar dan mencegah pemudaran.
- Pengolahan Air: Digunakan untuk menghilangkan klorin dan kelebihan oksigen dari air di instalasi pengolahan air industri dan kota. Ini juga membantu mencegah korosi pada pipa dan peralatan.
- Industri kertas dan pulp: digunakan dalam produksi kertas dan pulp untuk memutihkan dan mengurangi kandungan lignin pada pulp. Ini membantu meningkatkan kualitas dan warna kertas.
- Industri makanan: Digunakan sebagai pengawet dan antioksidan dalam industri makanan. Ini membantu mencegah perubahan warna dan pembusukan makanan, seperti buah-buahan kering, anggur, dan bir.
- Industri Tekstil: Digunakan sebagai zat pereduksi dan zat pemutih pada industri tekstil untuk menghilangkan kelebihan pewarna dan meningkatkan ketahanan luntur warna pada kain.
- Industri kimia: Digunakan sebagai zat pereduksi dalam berbagai reaksi kimia, seperti dalam produksi pewarna, obat-obatan, dan polimer.
- Kegunaan lain: Juga digunakan dalam pembuatan deterjen, produk kulit dan produk perawatan pribadi, seperti pewarna rambut dan sampo.
Pertanyaan:
T: Apa yang dimaksud dengan natrium sulfit normal dalam ketel?
J: Konsentrasi normal Na2SO3 dalam boiler umumnya antara 20 dan 40 bagian per juta (ppm), tergantung pada tekanan operasi dan faktor lainnya.
T: Bagaimana cara menyeimbangkan sulfur dioksida dengan natrium hidroksida untuk membentuk natrium sulfit dan air?
J: Untuk menyetarakan persamaan reaksi sulfur dioksida dan natrium hidroksida untuk membentuk Na2SO3 dan air, Anda harus memastikan bahwa terdapat jumlah atom yang sama dari setiap unsur di kedua sisi persamaan. Persamaan setaranya adalah SO2 + 2NaOH → Na2SO3 + H2O.
T: Apa itu natrium sulfit?
A: Na2SO3 adalah senyawa kristal putih yang biasa digunakan dalam berbagai aplikasi industri dan komersial, seperti fotografi, pengolahan air, produksi kertas dan pengawetan makanan.
Q: Apa rumus natrium sulfit?
A: Rumus natrium sulfit adalah Na2SO3.
T: Apakah berbahan dasar natrium sulfit?
A: Na2SO3 adalah garam dari basa kuat (natrium hidroksida) dan asam lemah (asam belerang) sehingga memiliki sifat basa. Namun, hal ini umumnya tidak dianggap sebagai landasan yang kokoh.
T: Apakah natrium sulfit stabil dalam air?
J: Na2SO3 relatif stabil di dalam air, namun secara bertahap dapat terurai seiring berjalannya waktu, terutama dengan adanya oksigen atau zat pengoksidasi lainnya.
T: Apakah natrium sulfit mudah terbakar?
J: Na2SO3 tidak mudah terbakar, namun dapat bereaksi dengan zat pengoksidasi tertentu untuk melepaskan sulfur dioksida, yang merupakan iritasi pernapasan dan mudah terbakar.
T: Di mana bisa membeli natrium sulfit secara lokal?
J: Na2SO3 dapat dibeli dari perusahaan pemasok bahan kimia, pemasok industri, dan beberapa pengecer khusus. Ini mungkin juga tersedia di beberapa toko perangkat keras lokal atau pusat perbaikan rumah.
T: Makanan apa saja yang mengandung natrium sulfit?
A: Na2SO3 umumnya digunakan sebagai pengawet pada makanan seperti anggur, bir, buah-buahan kering dan beberapa daging olahan.
T: Produk apa yang setara dengan natrium sulfit?
A: Natrium bisulfit adalah senyawa serupa yang dapat digunakan sebagai pengganti Na2SO3 dalam beberapa aplikasi. Pengganti lain mungkin termasuk natrium metabisulfit atau kalium metabisulfit.
