Natrium sulfat adalah senyawa kristal putih dengan rumus Na2SO4. Ini digunakan dalam industri deterjen, pembuatan kertas dan pembuatan kaca sebagai pengisi, bahan pengering dan pencegah busa.
| Nama IUPAC | Dinatrium sulfat |
| Formula molekul | Na2SO4 |
| nomor CAS | 7757-82-6 |
| Sinonim | Dinatrium sulfat, natrium sulfat anhidrat, natrium sulfat |
| Di ChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/jam;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Jisim Molar
Natrium sulfat memiliki massa molar 142,04 g/mol. Ini adalah senyawa ionik yang terdiri dari dua kation natrium (Na+) dan anion sulfat (SO42-). Massa molar dihitung dengan menjumlahkan massa atom semua atom dalam molekul natrium sulfat. Dalam hal ini, kita mempunyai dua atom natrium dengan massa masing-masing 22,99 g/mol, satu atom belerang dengan massa 32,06 g/mol, dan empat atom oksigen dengan massa masing-masing 15,99 g/mol. Menambahkannya bersama-sama memberi kita massa molar natrium sulfat.
Titik didih natrium sulfat
Natrium sulfat memiliki titik didih tinggi yaitu 1.429 °C (2.604 °F). Hal ini disebabkan oleh sifat ionik senyawa tersebut, yang menciptakan gaya tarik elektrostatis yang kuat antara ion natrium yang bermuatan positif dan ion sulfat yang bermuatan negatif. Untuk mengatasi gaya-gaya tersebut diperlukan energi yang besar, itulah sebabnya titik didih natrium sulfat sangat tinggi.
Titik lebur natrium sulfat
Titik leleh natrium sulfat bervariasi tergantung pada kandungan airnya. Natrium sulfat anhidrat (tanpa air) memiliki titik leleh 884°C (1,623°F). Namun, natrium sulfat dekahidrat (dengan sepuluh molekul air) meleleh pada suhu yang lebih rendah yaitu 32,4°C (90,3°F). Kehadiran molekul air dalam struktur kristal natrium sulfat dekahidrat melemahkan ikatan ion antara ion natrium dan sulfat, sehingga menurunkan titik leleh.
Massa jenis natrium sulfat g/ml
Kepadatan natrium sulfat bervariasi tergantung pada bentuknya. Natrium sulfat anhidrat memiliki massa jenis 2,664 g/cm3, sedangkan natrium sulfat dekahidrat memiliki massa jenis 1,464 g/cm3. Perbedaan densitas ini disebabkan oleh adanya molekul air dalam struktur kristal dekahidrat, yang meningkatkan volumenya dan menurunkan densitasnya.
Berat Molekul Natrium Sulfat
Berat molekul natrium sulfat adalah 142,04 g/mol. Ini adalah massa molekul natrium sulfat, yang terdiri dari dua ion natrium dan satu ion sulfat.
Struktur natrium sulfat
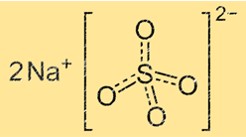
Natrium sulfat memiliki struktur kristal yang terdiri dari unit berulang ion natrium dan sulfat. Ion sulfat berbentuk tetrahedron dengan empat atom oksigen di sudut dan satu atom belerang di tengah. Ion natrium adalah bola kecil yang terletak di antara ion sulfat. Struktur kristal natrium sulfat dapat bervariasi tergantung pada kandungan airnya. Natrium sulfat anhidrat memiliki struktur kristal yang berbeda dengan natrium sulfat dekahidrat.
Rumus natrium sulfat
Rumus kimia natrium sulfat adalah Na2SO4. Artinya setiap molekul natrium sulfat mengandung dua ion natrium (Na+) dan satu ion sulfat (SO42-). Rumusnya mewakili rasio bilangan bulat paling sederhana dari atom-atom dalam suatu molekul senyawa.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,664 g/cm3 (anhidrat), 1,464 g/cm3 (dekahidrat) |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 142,04 g/mol |
| Kepadatan | 2,664 g/cm3 (anhidrat), 1,464 g/cm3 (dekahidrat) |
| Titik fusi | 884°C (anhidrat), 32,4°C (dekahidrat) |
| Titik didih | 1.429°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 44,1 g/100 mL (anhidrat), 47,6 g/100 mL (dekahidrat) |
| Kelarutan | Larut dalam air, tidak larut dalam etanol |
| Tekanan uap | 0,01 mmHg pada 20°C |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 1: 2.01, 2: 7.20, 3: 9.41 |
| pH | 9-11 (larutan 10%) |
Keamanan dan bahaya natrium sulfat
Natrium sulfat umumnya dianggap aman untuk digunakan, namun dapat menyebabkan iritasi atau kerusakan dalam keadaan tertentu. Ini dapat mengiritasi kulit, mata dan sistem pernafasan melalui kontak atau inhalasi. Penelanan dalam jumlah besar dapat menyebabkan mual, muntah dan diare. Hal ini juga dapat membahayakan kehidupan akuatik jika dilepaskan ke saluran air. Natrium sulfat tidak dianggap sebagai bahan yang mudah terbakar atau meledak. Namun, bila dipanaskan atau terkena suhu tinggi, dapat mengeluarkan asap beracun. Penting untuk mengikuti prosedur penanganan yang benar, memakai peralatan pelindung, dan menyimpan natrium sulfat di lokasi yang aman dan terlindungi.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | S24/25: Hindari kontak dengan kulit dan mata. S36/37: Kenakan pakaian pelindung dan sarung tangan yang sesuai. |
| Nomor identifikasi PBB | PBB 2118 |
| kode HS | 2833.11.00 |
| Kelas bahaya | Tidak berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | LD50 (oral, tikus): 5,900 mg/kg |
Metode sintesis natrium sulfat
Ada berbagai metode untuk mensintesis natrium sulfat, termasuk mereaksikan natrium klorida dengan asam sulfat atau mereaksikan natrium hidroksida dengan asam sulfat.
Untuk menghasilkan natrium sulfat, reaksi natrium klorida dan asam sulfat menghasilkan natrium sulfat dan gas hidrogen klorida. Proses ini meminimalkan asap berbahaya dengan melakukan reaksi eksotermik dalam kondisi terkendali. Selanjutnya larutan mengalami penyaringan sebelum diuapkan untuk menghasilkan kristal natrium sulfat.
Sintesis natrium sulfat juga melibatkan penggabungan asam sulfat dan natrium hidroksida untuk membentuk natrium sulfat dan air. Reaksinya eksotermik dan memerlukan penanganan yang hati-hati agar tidak meluap. Setelah menyaring campuran, larutan yang dihasilkan diuapkan untuk menghasilkan kristal natrium sulfat.
Metode lain melibatkan reaksi natrium karbonat dengan asam sulfat, menghasilkan natrium sulfat, air dan karbon dioksida. Cara ini memerlukan penggunaan lemari asam karena keluarnya asap beracun. Larutannya kemudian disaring dan diuapkan untuk memperoleh kristal natrium sulfat.
Proses industri lainnya, seperti produksi rayon, deterjen, dan kaca, juga menghasilkan natrium sulfat sebagai produk sampingan. Proses ini menghasilkan natrium sulfat sebagai limbah, yang dapat dimurnikan dan digunakan kembali untuk keperluan lain.
Kegunaan natrium sulfat
Natrium sulfat memiliki kegunaan yang luas di berbagai industri, antara lain:
- Deterjen: Digunakan sebagai pengisi deterjen bubuk, membantu meningkatkan volume dan meningkatkan aliran produk.
- Kaca: Digunakan sebagai fluks dalam pembuatan kaca, membantu mengurangi titik leleh dan meningkatkan kejernihan produk akhir.
- Tekstil: Digunakan dalam produksi serat sintetis, seperti rayon, untuk meningkatkan kekuatan dan daya tahan bahan.
- Kertas: Digunakan sebagai bahan pembuat pulp dalam produksi kertas, membantu memecah serat kayu dan menghilangkan kotoran.
- Makanan: Digunakan sebagai bahan tambahan makanan, terutama sebagai pengental dan pengemulsi dalam makanan olahan.
- Obat-obatan: Digunakan dalam produksi obat-obatan tertentu, seperti obat pencahar, untuk membantu mengobati sembelit.
- Bahan kimia: Digunakan dalam produksi berbagai bahan kimia, termasuk natrium sulfida, natrium silikat, dan natrium bikarbonat.
- Pengolahan Air: Digunakan di pabrik pengolahan air untuk menghilangkan ion kalsium dan magnesium dari air sadah.
- Pengeboran minyak: Digunakan dalam pengeboran minyak sebagai bahan pembobot, membantu mengontrol kepadatan cairan pengeboran.
Pertanyaan:
Q: Apa rumus natrium sulfat?
A: Rumus kimia natrium sulfat adalah Na2SO4.
T: Apa itu natrium sulfat?
A: Natrium sulfat adalah padatan kristal putih yang biasa digunakan dalam berbagai aplikasi industri, termasuk deterjen, kaca, tekstil, kertas, dan makanan.
T: Apakah natrium sulfat bersifat asam atau basa?
J: Natrium sulfat tidak bersifat asam atau basa; itu adalah senyawa netral.
T: Apa warna natrium sulfat? A: Natrium sulfat adalah padatan kristal putih sehingga tidak berwarna.
