Natrium perklorat adalah senyawa kimia dengan rumus NaClO4. Ini adalah padatan kristal putih yang sangat larut dalam air dan biasa digunakan sebagai zat pengoksidasi dalam berbagai proses industri.
| Nama IUPAC | Natrium perklorat |
| Formula molekul | NaClO4 |
| nomor CAS | 7601-89-0 |
| Sinonim | Asam perklorat, garam natrium; Natrium perklorat (Perancis); Natrium perklorat (Jerman); Perclorato di sodio (Italia); Perclorato sodico (Spanyol); PBB 1502 |
| Di ChI | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Sifat natrium perklorat
Rumus natrium perklorat
Rumus kimia natrium perklorat adalah NaClO4. Artinya senyawa tersebut terdiri dari satu atom natrium, satu atom klor, dan empat atom oksigen. Natrium perklorat merupakan oksidator kuat yang biasa digunakan dalam berbagai proses industri.
Massa Molar Natrium Perklorat
Massa molar NaClO4 adalah 122,44 g/mol. Artinya, satu mol NaClO4 mengandung 122,44 gram senyawa tersebut. Massa molar suatu senyawa penting dalam menentukan jumlah zat yang dibutuhkan untuk suatu reaksi kimia.
Titik didih natrium perklorat
Titik didih NaClO4 adalah 545°C (1013 hPa). Ini adalah suhu di mana senyawa berubah dari cair menjadi gas. NaClO4 memiliki titik didih yang tinggi karena adanya gaya elektrostatis yang kuat antara ion natrium dan perklorat.
Natrium perklorat Titik lebur
Titik leleh NaClO4 adalah 482°C. Ini adalah suhu di mana senyawa berubah dari padat menjadi cair. NaClO4 memiliki titik leleh yang tinggi karena adanya gaya elektrostatis yang kuat antara ion natrium dan perklorat.
Massa jenis natrium perklorat g/mL
Massa jenis NaClO4 adalah 2,52 g/mL. Artinya satu mililiter NaClO4 beratnya 2,52 gram. Massa jenis suatu zat penting dalam menentukan sifat fisiknya, seperti daya apung dan viskositas.
Berat Molekul Natrium Perklorat
Berat molekul NaClO4 adalah 122,44 g/mol. Ini adalah jumlah berat atom atom natrium, klor, dan oksigen dalam senyawa. Berat molekul suatu senyawa penting dalam menentukan sifat fisik dan kimianya.
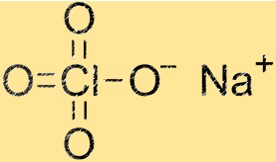
Struktur natrium perklorat
Struktur NaClO4 adalah kisi kristal yang tersusun dari kation Na+ dan anion ClO4-. Kation natrium dikelilingi oleh empat atom oksigen, sedangkan anion ClO4- terdiri dari satu atom klor dan empat atom oksigen. Struktur kisi kristal memberi NaClO4 sifat fisik dan kimia yang khas.
Kelarutan natrium perklorat
NaClO4 sangat larut dalam air, dengan kelarutan 209 g/100 mL pada 20°C. Artinya NaClO4 dalam jumlah besar dapat larut dalam sedikit air. Kelarutan NaClO4 yang tinggi membuatnya berguna dalam berbagai proses industri, seperti produksi amonium perklorat untuk bahan bakar roket.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,52 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 122,44 g/mol |
| Kepadatan | 2,52 gram/ml |
| Titik fusi | 482°C |
| Titik didih | 545°C (1013hPa) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 209 g/100 mL pada 20°C |
| Kelarutan | Larut dalam air dan etanol |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya natrium perklorat
NaClO4 merupakan senyawa berbahaya yang harus ditangani dengan hati-hati. Ini adalah zat pengoksidasi kuat yang dapat bereaksi hebat dengan bahan organik, zat pereduksi, dan bahan kimia lainnya. Paparan debu atau uap NaClO4 dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan. Menelan NaClO4 dapat menyebabkan iritasi gastrointestinal, mual dan muntah. NaClO4 juga berbahaya bagi kehidupan akuatik dan harus dibuang dengan benar. Peralatan pelindung diri seperti sarung tangan, kacamata dan respirator harus dipakai saat menangani NaClO4 untuk menghindari paparan. Ventilasi dan penyimpanan yang baik juga penting untuk meminimalkan risiko kecelakaan.
| Simbol bahaya | Oh, Xn |
| Deskripsi Keamanan | Jangan menghirup debu/asap/gas/kabut/uap/semburan. Kenakan sarung tangan pelindung/pakaian pelindung/pelindung mata/pelindung wajah. JIKA TERHIRUP: Pindahkan korban ke tempat berudara segar dan istirahatkan pada posisi yang nyaman untuk bernapas. JIKA TERTELAN: Bilas mulut. JANGAN memaksakan muntah. Hubungi PUSAT RACUN atau dokter jika Anda merasa tidak sehat. |
| Nomor identifikasi PBB | UN1502 |
| kode HS | 2829.90.90 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan, berbahaya jika terhirup atau terkena kulit. Dapat menyebabkan iritasi atau korosi. |
Metode sintesis natrium perklorat
Berbagai metode dapat mensintesis NaClO4.
Metode yang umum melibatkan reaksi natrium klorat dengan asam klorida , menghasilkan pembentukan NaClO4 dan natrium klorida .
Metode lain melibatkan elektrolisis larutan natrium klorida dengan adanya garam perklorat. Terjadi konversi natrium klorida menjadi natrium klorat, diikuti dengan penambahan asam klorida, yang mengubahnya menjadi NaClO4.
Pendekatan lain adalah dengan mereaksikan natrium klorat dengan natrium klorida dengan adanya asam sulfat. Metode ini menghasilkan campuran NaClO4 dan natrium sulfat, yang dapat dipisahkan melalui kristalisasi fraksional.
Metode lain melibatkan reaksi natrium klorat dengan amonium perklorat, yang menghasilkan NaClO4 dan amonium klorida. Produksi NaClO4, yang biasa digunakan sebagai oksidan dalam propelan roket padat, melibatkan penggunaan metode ini.
Reaksi natrium hipoklorit dengan natrium klorat dengan adanya asam klorida juga menghasilkan NaClO4. Metode ini menghasilkan NaClO4 dan natrium klorida sebagai produk utama.
Kegunaan natrium perklorat
NaClO4 memiliki berbagai kegunaan di berbagai industri. Berikut adalah beberapa aplikasi umum NaClO4:
- Propelan Roket: Biasa digunakan sebagai oksidator pada propelan roket padat karena kandungan oksigennya yang tinggi dan stabilitasnya yang tinggi.
- Kembang api: Digunakan sebagai oksidator dalam komposisi kembang api seperti suar, kembang api, dan suar.
- Kimia Analitik: Digunakan sebagai sumber ion perklorat dalam kimia analitik untuk penentuan ion dalam berbagai sampel.
- Elektroplating: Digunakan sebagai komponen dalam larutan pelapisan listrik untuk meningkatkan konduktivitas dan stabilitas bak pelapisan.
- Baterai: Digunakan sebagai elektrolit pada baterai lithium-ion, karena kelarutannya yang tinggi dan kemampuannya untuk meningkatkan sifat elektrokimia baterai.
- Aplikasi Medis: Digunakan dalam pengobatan gangguan tiroid sebagai penghambat kompetitif transportasi yodium. Juga digunakan dalam produksi zat kontras untuk pencitraan medis.
- Pengolahan Air: Digunakan dalam pengolahan air sebagai desinfektan dan untuk menghilangkan kontaminan tertentu dari air.
Pertanyaan:
Q: Apa rumus natrium perklorat?
Jawaban: NaClO4.
T: Apakah natrium perklorat larut dalam air?
A: Ya, NaClO4 sangat larut dalam air.
Q: Apakah natrium perklorat termasuk asam atau basa?
Jawaban: NaClO4 bukanlah asam atau basa. Itu garam.
T: Bagaimana reaksi amonium perklorat dan natrium bromida?
Jawaban: Reaksinya adalah: NH4ClO4 + NaBr → NaClO4 + NH4Br.
T: Berapa banyak ion natrium dalam natrium perklorat?
A: Ada ion natrium dalam NaClO4.
Q: Apakah NaClO4 termasuk asam atau basa?
Jawaban: NaClO4 bukanlah asam atau basa. Itu garam.
T: Spesies terlarut apa yang terdapat dalam larutan NaClO4?
A: Dalam larutan NaClO4, spesies terlarut adalah ion Na+ dan ClO4-.
Q: Berapa mol oksigen dalam 3,30 mol NaClO4?
A: Terdapat 13,2 mol oksigen dalam 3,30 mol NaClO4.
Q: Apakah NaClO4 larut dalam air?
A: Ya, NaClO4 sangat larut dalam air.
Q: Berapa mol oksigen dalam 1,10 mol NaClO4?
A: Terdapat 4,4 mol oksigen dalam 1,10 mol NaClO4.
