Natrium klorat adalah senyawa kimia dengan rumus NaClO3. Ini adalah zat pengoksidasi kuat yang biasa digunakan dalam produksi korek api, pewarna dan herbisida.
| Nama IUPAC | Natrium klorat |
| Formula molekul | NaClO3 |
| nomor CAS | 7775-09-9 |
| Sinonim | Asam klorida, garam natrium; Naklo3; Asam klorida, garam natrium (1:1); UN1495; natrium klorat; Natrium klorida; |
| Di ChI | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Sifat natrium klorat
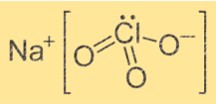
Rumus Natrium Klorat
Rumus kimia natrium klorat adalah NaClO3. Ini adalah senyawa ionik yang terdiri dari satu ion Na+ dan satu ion ClO3-. Ion Na+ bermuatan positif, sedangkan ion ClO3- bermuatan negatif. Rumusnya menunjukkan bahwa ion Na+ bergabung dengan ion ClO3- untuk membentuk senyawa.
Massa Molar Natrium Klorat
Massa molar NaClO3 adalah 106,44 g/mol. Ini adalah massa satu mol senyawa yang mengandung jumlah molekul Avogadro (6,022 x 10^23). Ini dihitung dengan menjumlahkan massa atom semua atom dalam senyawa.
Titik didih natrium klorat
Titik didih NaClO3 adalah 300°C (572°F). Ini adalah suhu di mana senyawa berubah dari cair menjadi gas. Titik didih ditentukan oleh kekuatan gaya antarmolekul antarmolekul.
Titik leleh natrium klorat
Titik leleh NaClO3 adalah 248°C (478°F). Ini adalah suhu di mana senyawa berubah dari padat menjadi cair. Titik leleh ditentukan oleh kekuatan gaya antarmolekul antar molekul.
Massa jenis natrium klorat g/mL
Massa jenis NaClO3 adalah 2,49 g/mL. Ini adalah massa senyawa per satuan volume. Massa jenis ditentukan oleh massa dan volume suatu zat.
Berat Molekul Natrium Klorat
Berat molekul NaClO3 adalah 106,44 g/mol. Ini adalah jumlah berat atom seluruh atom dalam senyawa.
Struktur natrium klorat
Struktur NaClO3 adalah kristal. Ion Na+ dikelilingi oleh enam atom oksigen dari enam ion ClO3- yang berbeda. Ion ClO3- membentuk bentuk tetrahedral di sekitar ion Na+. Strukturnya disatukan oleh ikatan ionik antara ion Na+ dan ion ClO3-.
Kelarutan natrium klorat
NaClO3 larut dalam air, etanol dan metanol. Ini mudah larut dalam air untuk membentuk larutan bening dan tidak berwarna. Kelarutan NaClO3 dalam air meningkat seiring dengan peningkatan suhu. Pada 20°C, kelarutannya adalah 85 g/100 mL air.
| Penampilan | Padatan putih |
| Berat jenis | 2,49 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 106,44 g/mol |
| Kepadatan | 2,49g/ml |
| Titik fusi | 248°C (478°F) |
| Titik didih | 300°C (572°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 85g/100ml |
| Kelarutan | Larut dalam air, etanol dan metanol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Netral (7) |
Keamanan dan Bahaya Natrium Klorat
NaClO3 adalah zat pengoksidasi kuat dan harus ditangani dengan hati-hati. Terdapat potensi risiko kebakaran dan ledakan jika bersentuhan dengan bahan organik seperti kertas, kayu, atau minyak. Ia juga dapat bereaksi hebat dengan zat pereduksi, asam, dan bubuk logam. Menelan atau menghirup NaClO3 dapat menyebabkan efek kesehatan yang serius, seperti gangguan pernapasan, sakit perut, dan muntah. NaClO3 juga dapat mengiritasi kulit, mata, dan sistem pernapasan. Peralatan pelindung yang tepat, termasuk sarung tangan, kacamata, dan respirator, harus dipakai saat bekerja dengan NaClO3 untuk menghindari paparan dan potensi bahaya.
| Simbol bahaya | Agen pengoksidasi |
| Deskripsi Keamanan | Berbahaya jika tertelan, menyebabkan iritasi mata yang serius, dapat menyebabkan iritasi saluran pernapasan |
| Nomor identifikasi PBB | PBB 1495 |
| kode HS | 2829.19.00 |
| Kelas bahaya | 5.1 (Bahan pengoksidasi) |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan atau terhirup, mengiritasi kulit dan mata |
Metode sintesis natrium klorat
Ada beberapa metode untuk mensintesis NaClO3.
Metode yang umum adalah dengan mengelektrolisis larutan natrium klorida . Hal ini melibatkan aliran arus listrik melalui larutan, yang menyebabkan natrium klorida terurai menjadi NaClO3 dan gas klor. Metode lain melibatkan mereaksikan natrium hidroksida dengan gas klor untuk membentuk NaClO3 dan natrium klorida.
Metode ketiga melibatkan reaksi natrium karbonat dengan gas klor dengan adanya katalis. Ini menghasilkan NaClO3, natrium klorida dan karbon dioksida. Reaksi antara natrium hipoklorit dan natrium hidroksida dapat menghasilkan NaClO3 sebagai alternatif. Reaksi ini menghasilkan pembentukan NaClO3, natrium klorida dan air.
Selain metode tersebut, NaClO3 juga dapat diproduksi melalui reaksi natrium klorit dengan hidrogen peroksida. Reaksi ini menghasilkan pembentukan NaClO3, air dan gas oksigen.
Kegunaan natrium klorat
NaClO3 memiliki kegunaan yang beragam di berbagai industri. Beberapa kegunaan umum meliputi:
- Herbisida: Banyak digunakan sebagai herbisida, terutama untuk mengendalikan gulma di area yang tidak ditanami seperti pinggir jalan, jalur kereta api, dan kabel listrik. Dengan mengganggu fotosintesis tanaman, ia dapat mengendalikan berbagai gulma secara efektif.
- Pemutih: Digunakan dalam industri pulp dan kertas sebagai bahan pemutih. Hal ini sangat efektif dalam menghasilkan kertas putih cerah berkualitas tinggi.
- Pertambangan: Digunakan dalam industri pertambangan sebagai zat pengoksidasi untuk ekstraksi emas dan logam mulia lainnya.
- Bahan Peledak: Digunakan sebagai bahan dalam pembuatan bahan peledak seperti dinamit dan amonium klorat.
- Pewarna dan pigmen: Digunakan dalam produksi pewarna dan pigmen, khususnya untuk mewarnai tekstil.
- Laboratorium: Digunakan di laboratorium sebagai reagen untuk berbagai reaksi kimia.
- Pengolahan Air: Digunakan dalam pengolahan air untuk mengendalikan pertumbuhan alga dan sebagai desinfektan.
- Pengawet makanan: Juga digunakan sebagai pengawet makanan untuk memperpanjang umur simpan makanan tertentu.
Pertanyaan:
T: Bagaimana cara membuat natrium klorat?
A: NaClO3 dapat diproduksi dengan beberapa metode seperti elektrolisis larutan natrium klorida, reaksi natrium hidroksida dengan gas klor, dan reaksi natrium karbonat dengan gas klor dengan adanya katalis.
T: Berapa lama waktu yang dibutuhkan natrium klorat untuk membunuh gulma?
J: NaClO3 adalah herbisida yang kuat dan dapat membunuh gulma dalam beberapa hari setelah aplikasi. Waktu yang diperlukan untuk membunuh gulma dapat berbeda-beda tergantung pada faktor seperti konsentrasi NaClO3 yang digunakan dan jenis gulma yang dijadikan sasaran.
T: Apakah natrium klorat merupakan zat murni?
J: Ya, NaClO3 adalah zat murni karena merupakan senyawa yang hanya terdiri dari atom natrium, klor, dan oksigen.
T: Apakah natrium klorat larut dalam air?
A: Ya, NaClO3 sangat larut dalam air. Ia dapat larut dalam air untuk membentuk larutan bening dan tidak berwarna.
Q: Berapa banyak atom oksigen yang ada dalam molekul natrium klorat?
J: Molekul NaClO3 memiliki tiga atom oksigen. Rumus kimianya adalah NaClO3.
T: Apakah natrium klorat bersifat ionik atau kovalen?
Jawaban: NaClO3 merupakan senyawa ionik. Ini terbentuk oleh transfer elektron dari atom natrium ke atom klor untuk membentuk ion Na+ yang bermuatan positif dan ion NaClO3 yang bermuatan negatif.
