Natrium etoksida adalah basa kuat yang dibentuk oleh reaksi natrium dengan etanol. Ini digunakan dalam sintesis organik untuk memfasilitasi reaksi seperti esterifikasi dan deprotonasi.
| Nama IUPAC | Natrium etoksida |
| Formula molekul | C2H5NaO |
| nomor CAS | 141-52-6 |
| Sinonim | Etanol, garam natrium; Natrium etoksida; Etil natrium; Etilat; Natrium etil alkoholat |
| Di ChI | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
Sifat natrium etoksida
Rumus Natrium Etoksida
Rumus kimia natrium etoksida adalah C2H5NaO. Terdiri dari dua atom karbon (C), lima atom hidrogen (H), satu atom natrium (Na) dan satu atom oksigen (O). Rumusnya mewakili rasio atom yang ada dalam molekul natrium etoksida.
Massa Molar Natrium Etoksida
Massa molar natrium etoksida dihitung dengan menjumlahkan massa atom semua atom dalam rumusnya. Natrium (Na) memiliki massa molar 22,99 g/mol, karbon (C) memiliki massa molar 12,01 g/mol, hidrogen (H) memiliki massa molar 1,01 g/mol mol dan oksigen (O) memiliki massa molar massa 1,01 g/mol. massa 16,00 g/mol. Penambahannya menghasilkan massa molar sekitar 68,06 g/mol untuk natrium etoksida.
Titik didih natrium etoksida
Natrium etoksida memiliki titik didih sekitar 90-95°C (194-203°F). Suhu ini menunjukkan titik di mana natrium etoksida berubah dari fase cair menjadi fase gas ketika dipanaskan pada tekanan atmosfer standar.
Titik lebur natrium etoksida
Titik leleh natrium etoksida kira-kira 260-270°C (500-518°F). Ini berarti suhu di mana natrium etoksida padat berubah menjadi cair.
Massa jenis natrium etoksida g/mL
Natrium etoksida memiliki kepadatan sekitar 0,868 g/mL. Massa jenis mengacu pada massa suatu zat per satuan volume dan dapat digunakan untuk menentukan berat atau ringan relatifnya dibandingkan dengan volume air yang sama.
Berat Molekul Natrium Etoksida
Berat molekul natrium etoksida, juga disebut berat molekul, adalah sekitar 68,06 g/mol. Ini dihitung dengan menambahkan massa atom dari semua atom yang ada dalam molekul natrium etoksida.
Struktur natrium etoksida
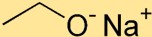
Natrium etoksida memiliki struktur di mana atom natrium (Na) dihubungkan dengan atom oksigen (O) melalui ikatan ionik. Gugus etoksida, terdiri dari dua atom karbon (C) dan lima atom hidrogen (H), terikat pada atom natrium.
Kelarutan natrium etoksida
Natrium etoksida sangat larut dalam pelarut polar seperti etanol (C2H5OH) dan pelarut organik lainnya. Ia mudah larut dalam pelarut ini untuk membentuk larutan bening dan tidak berwarna, sehingga memudahkan penggunaannya sebagai reagen dalam berbagai reaksi organik.
| Penampilan | Padat tidak berwarna |
| Berat jenis | 0,868 gram/ml |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 68,06 g/mol |
| Kepadatan | 0,868 gram/ml |
| Titik fusi | 260-270°C (500-518°F) |
| Titik didih | 90-95°C (194-203°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan air |
| Kelarutan | Larut dalam etanol (C2H5OH) dan pelarut organik lainnya |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Dasar (basa) |
Keamanan dan Bahaya Natrium Etoksida
Natrium etoksida menimbulkan beberapa risiko keamanan dan kehati-hatian harus dilakukan saat menanganinya. Ini adalah zat korosif yang dapat menyebabkan luka bakar parah pada kulit, mata, dan sistem pernapasan. Kontak langsung harus dihindari dan sarung tangan, kacamata dan pakaian pelindung harus dipakai. Ia bereaksi hebat dengan air, melepaskan gas hidrogen yang mudah terbakar, dan harus disimpan jauh dari tempat lembab. Natrium etilat juga dapat bereaksi kuat dengan udara, sehingga berpotensi mengakibatkan kebakaran atau ledakan. Ventilasi yang baik sangat penting untuk mencegah penumpukan uap. Selain itu, penting untuk menangani natrium etoksida di laboratorium yang dilengkapi dengan personel terlatih untuk meminimalkan risiko dan memastikan keselamatan.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | – Menyebabkan luka bakar serius<br>- Bereaksi hebat jika terkena air<br>- Simpan jauh dari tempat lembab<br>- Tangani dengan hati-hati<br>- Gunakan peralatan pelindung<br>- Simpan di tempat yang kering<br>- Pastikan ventilasi yang baik |
| Nomor identifikasi PBB | UN2922 |
| kode HS | 2905.19.00 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan atau terhirup |
Metode sintesis natrium etoksida
Ada beberapa metode untuk mensintesis natrium etoksida.
Salah satu cara untuk mensintesis natrium etoksida melibatkan reaksi antara logam natrium dan etanol . Natrium logam mengalami reaksi redoks dengan etanol anhidrat, menghasilkan pembentukan natrium etoksida. Untuk melakukan reaksi, seseorang dapat menambahkan potongan kecil logam natrium ke dalam etanol absolut dan melakukan refluks campuran dalam kondisi terkendali.
Metode lain melibatkan reaksi antara natrium hidroksida (NaOH) dan etanol . Natrium hidroksida dilarutkan dalam etanol dan campuran dipanaskan, yang mendorong reaksi menghasilkan natrium etoksida. Ahli kimia biasanya menggunakan metode ini ketika mereka tidak menyukai reaksi langsung antara logam natrium dan etanol.
Sebagai alternatif, mereka dapat membuat natrium etoksida dengan mereaksikan etanol dengan natrium karbonat (Na2CO3). Larutkan natrium karbonat dalam etanol , lalu panaskan dan aduk campuran. Proses ini mengarah pada pembentukan natrium etoksida.
Perlu dicatat bahwa metode sintesis ini memerlukan kepatuhan yang ketat terhadap tindakan pencegahan keselamatan karena reaktivitas bahan kimia yang terlibat. Penanganan yang tepat terhadap bahan yang mudah terbakar, penggunaan peralatan pelindung, dan pelaksanaan reaksi di area yang berventilasi baik sangat penting untuk keselamatan pribadi dan keberhasilan sintesis natrium etoksida.
Kegunaan Natrium Etoksida
Natrium etoksida mempunyai berbagai kegunaan karena reaktivitasnya dan sifat basanya yang kuat. Berikut beberapa kegunaan umum:
- Sintesis Organik: Natrium etoksida berfungsi secara luas sebagai basa padat dalam sintesis organik. Ini memfasilitasi reaksi seperti proses esterifikasi, kondensasi dan deprotonasi.
- Reagen Alkoksida: Berfungsi sebagai reagen alkoksida yang dapat bereaksi dengan berbagai senyawa organik membentuk alkoksida. Alkoksida ini merupakan zat antara yang penting dalam banyak reaksi organik.
- Katalis: Natrium etoksida bertindak sebagai katalis dalam beberapa reaksi kimia. Ini mendorong konversi senyawa organik, seperti alkohol dan ester, menjadi eter atau produk esterifikasi yang sesuai.
- Agen dehidrasi: Ini mendehidrasi senyawa organik dengan menghilangkan molekul air, sehingga memfasilitasi sintesis produk anhidrat.
- Polimerisasi: Natrium etoksida berpartisipasi dalam reaksi polimerisasi, termasuk produksi polietilen tereftalat (PET) dan polimer poliester lainnya.
- Manufaktur farmasi: Ia menemukan aplikasi dalam industri farmasi untuk sintesis berbagai senyawa farmasi termasuk ester, eter dan zat antara.
- Produksi Biodiesel: Proses transesterifikasi menggunakan natrium etilat untuk mengubah minyak nabati atau lemak hewani menjadi biodiesel, bahan bakar terbarukan dan ramah lingkungan.
- Reagen Laboratorium: Para peneliti biasanya menggunakan natrium etoksida sebagai reagen untuk reaksi organik dan dalam pengaturan eksperimental.
Pertanyaan:
T: Apakah berbahan dasar natrium etoksida?
A: Ya, natrium etoksida adalah basa.
Q: Apakah natrium etoksida termasuk basa kuat atau basa lemah?
A: Natrium etoksida adalah basa kuat.
T: Apa yang Anda harapkan jika natrium etoksida ditambahkan ke dalam air?
J: Jika natrium etoksida ditambahkan ke dalam air, air akan bereaksi dengan kuat, melepaskan gas hidrogen dan membentuk natrium hidroksida.
Q: Apakah natrium etoksida termasuk basa kuat atau basa lemah?
A: Natrium etoksida adalah basa kuat.
T: Apakah natrium etoksida merupakan nukleofil kuat?
J: Ya, natrium etoksida adalah nukleofil kuat.
Q: Manakah dari berikut ini yang paling mudah mengalami reaksi E2 dengan natrium etoksida?
A: Senyawa dengan gugus pergi primer atau sekunder akan lebih mudah mengalami reaksi E2 dengan natrium etoksida.
T: Apakah natrium etoksida merupakan nukleofil kuat?
J: Ya, natrium etoksida adalah nukleofil kuat.
T: Apakah berbahan dasar natrium etoksida?
A: Ya, natrium etoksida adalah basa.
Q: Manakah dari berikut ini yang paling mudah mengalami reaksi E2 dengan natrium etoksida (NaOCH2CH3)?
J: Senyawa dengan gugus pergi primer atau sekunder akan lebih mudah mengalami reaksi E2 dengan natrium etoksida.
T: Apakah natrium etoksida mudah terbakar?
J: Natrium etoksida sendiri tidak mudah terbakar, namun bereaksi hebat dengan air, melepaskan gas hidrogen yang mudah terbakar.
T: Jika digabungkan dengan etanol, apa yang menghasilkan natrium etoksida dan hidrogen?
A: Kombinasi logam natrium dan etanol menghasilkan natrium etoksida dan gas hidrogen.
T: Apa yang Anda harapkan jika natrium etoksida ditambahkan ke dalam air?
J: Jika natrium etoksida ditambahkan ke dalam air, air akan bereaksi dengan kuat, melepaskan gas hidrogen dan membentuk natrium hidroksida.
