Natrium borohidrida (NaBH4) adalah bubuk kristal putih yang digunakan sebagai zat pereduksi dalam sintesis organik dan sebagai sumber hidrogen untuk sel bahan bakar. Ini sangat reaktif dan sensitif terhadap air.
| Nama IUPAC | Natrium tetrahidroborat |
| Formula molekul | NaBH4 |
| nomor CAS | 16940-66-2 |
| Sinonim | Natrium borohidrida, natrium tetrahididoborat, natrium borohidrida hidrat, natrium tetrahidroborat hidrat |
| Di ChI | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
Sifat natrium borohidrida
Titik didih natrium borohidrida
Natrium borohidrida tidak memiliki titik didih yang jelas karena terurai ketika dipanaskan. Suhu dekomposisi tergantung pada kondisi suhu dan tekanan.
Titik leleh natrium borohidrida
Natrium borohidrida memiliki titik leleh 240 hingga 242°C. Pada suhu ini, bentuk padat NaBH4 berubah menjadi cair.
Massa jenis natrium borohidrida g/ml
Massa jenis natrium borohidrida adalah 1,33 g/ml. Ini adalah padatan kristal putih yang relatif padat dibandingkan dengan zat lain.
Massa molar Natrium Borohidrida
Massa molar Natrium Borohidrida (NaBH4) adalah 37,83 g/mol. Ini dihitung dengan menjumlahkan massa atom semua atom yang ada dalam rumus molekul NaBH4 (1 atom natrium, 1 atom boron, dan 4 atom hidrogen).
Berat molekul natrium borohidrida
Berat molekul natrium borohidrida adalah 37,83 g/mol. Ini adalah jumlah massa atom masing-masing atom dalam rumus molekul NaBH4.
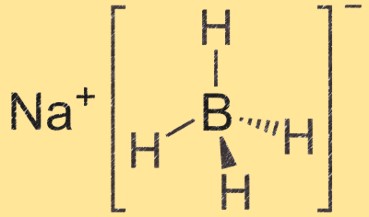
Struktur natrium borohidrida
Natrium borohidrida adalah molekul tetrahedral dengan ion natrium di tengahnya dan empat gugus boron hidrida melekat padanya. Atom boron terikat pada empat atom hidrogen, menciptakan struktur tetrahedral.
Rumus Natrium Borohidrida
Rumus kimia natrium tetrahidroborat adalah NaBH4. Ia terdiri dari satu atom natrium (Na), satu atom boron (B) dan empat atom hidrogen (H). Rumus ini mewakili komposisi kimia zat ini dan komposisi unsurnya.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 1,33g/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 37,83 g/mol |
| Kepadatan | 1,33g/ml |
| Titik fusi | 240-242°C |
| Titik didih | Terurai jika dipanaskan |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut dalam air |
| Kelarutan | Larut dalam pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya natrium borohidrida
Natrium tetrahidroborat mudah terbakar dan reaktif dengan air. Ia dapat melepaskan gas hidrogen yang mudah terbakar dan membentuk campuran yang mudah meledak dengan udara. Natrium tetrahidroborat juga menyebabkan iritasi pada kulit dan mata. Ventilasi yang memadai dan peralatan pelindung diri harus digunakan untuk meminimalkan paparan saat menangani natrium tetrahidroborat. Simpan di tempat sejuk dan kering, jauh dari sumber api dan air.
| Simbol bahaya | Mudah terbakar, Mengiritasi |
| Deskripsi Keamanan | S26, S36/37 |
| Nomor identifikasi PBB | UN3375 |
| kode HS | 2827.90.90 |
| Kelas bahaya | 4.3 |
| Kelompok pengepakan | II |
| Toksisitas | Cukup beracun jika tertelan, terhirup dan terkena kulit |
Metode sintesis natrium borohidrida
Natrium borohidrida (NaBH4) dapat disintesis dengan beberapa metode, antara lain:
- Reduksi natrium logam: Metode ini melibatkan reduksi boron trioksida (B2O3) dengan natrium logam untuk menghasilkan NaBH4.
- Reduksi Natrium Hidrida: Natrium hidrida (NaH) dapat digunakan untuk mereduksi boron trihalida untuk menghasilkan NaBH4.
- Reduksi Litium Aluminium Hidrida: Litium aluminium hidrida (LiAlH4) dapat digunakan untuk mereduksi boron halida untuk menghasilkan NaBH4.
- Hidrogenasi: Natrium borohidrida dapat disintesis dengan hidrogenasi natrium borohidrida (NaBH3H).
Peralatan khusus dan personel terlatih di lingkungan yang berventilasi baik harus melakukan semua metode ini karena natrium tetrahidroborat mudah terbakar dan reaktif. Metode sintesis yang dipilih akan bergantung pada hasil yang diinginkan, kemurnian, dan pertimbangan biaya.
Kegunaan natrium borohidrida
Natrium tetrahidroborat (NaBH4) merupakan zat pereduksi serbaguna dan memiliki cakupan aplikasi yang luas di berbagai bidang. Beberapa kegunaan umum natrium tetrahidroborat adalah:
- Sintesis Organik: NaBH4 digunakan dalam reduksi senyawa karbonil, ester, nitril, dan Amida menjadi alkohol, aldehida, dan amina yang sesuai.
- Farmasi: Natrium tetrahidroborat digunakan dalam sintesis berbagai bahan aktif farmasi dan dalam pembuatan senyawa kiral.
- Ilmu Polimer: NaBH4 digunakan dalam reduksi resin epoksi dan resin poliester tak jenuh.
- Lingkungan: Natrium tetrahidroborat dapat digunakan dalam pengolahan air limbah untuk mengurangi polutan seperti logam berat dan pewarna.
- Industri Makanan: NaBH4 digunakan sebagai zat pereduksi dalam produksi olesan rendah lemak, es krim, dan coklat.
Secara keseluruhan, natrium tetrahidroborat telah terbukti menjadi alat yang berharga dalam bidang sintesis kimia karena sifat pereduksinya yang ringan dan kemampuannya untuk mereduksi gugus fungsi secara selektif dalam struktur molekul yang kompleks.
Pertanyaan:
Senyawa manakah yang dapat direduksi dengan natrium borohidrida? centang semua yang sesuai.
Natrium tetrahidroborat (NaBH4) dapat mereduksi berbagai macam senyawa, antara lain:
- Senyawa karbonil, seperti aldehida dan keton
- Nitril
- Ester
- Amida
- Resin epoksi
- Resin poliester tak jenuh
- Pewarna tertentu
- Logam berat
- Senyawa kiral
Penting untuk dicatat bahwa kondisi spesifik dan parameter reaksi dapat mempengaruhi efisiensi reduksi dan selektivitas proses reduksi. Selain itu, tidak semua senyawa cocok untuk direduksi dengan natrium tetrahidroborat, karena beberapa senyawa mungkin mengalami reaksi samping yang tidak diinginkan.
Mengapa penting untuk memaparkan natrium borohidrida pada kelembapan?
Paparan natrium tetrahidroborat (NaBH4) terhadap kelembapan penting karena beberapa alasan:
- Reaktivitas: Natrium tetrahidroborat sangat reaktif dan dapat terurai dengan cepat jika ada uap air, menghasilkan gas hidrogen dan panas. Hal ini dapat menimbulkan risiko ledakan dan kebakaran jika tidak ditangani dengan benar.
- Hidrolisis: Natrium tetrahidroborat mudah terhidrolisis dengan adanya uap air untuk membentuk natrium tetrahidroborat hidrat (NaBH4.xH2O), yang memiliki sifat pereduksi yang lebih rendah dibandingkan dengan bentuk anhidrat.
- Stabilitas Penyimpanan: Kelembapan dapat menyebabkan natrium tetrahidroborat terurai secara bertahap, sehingga mengurangi umur simpan dan efektivitasnya sebagai zat pereduksi.
Oleh karena itu, penting untuk menyimpan natrium borohidrida dalam wadah yang kering dan kedap udara dan menanganinya di lingkungan yang berventilasi baik untuk meminimalkan paparan terhadap kelembapan. Jika paparan terhadap uap air tidak dapat dihindari, penggunaan bahan penghilang kelembapan atau atmosfer pelindung dapat membantu meminimalkan dampaknya terhadap stabilitas dan reaktivitas natrium tetrahidroborat.
Apakah natrium borohidrida merupakan katalis?
Natrium tetrahidroborat (NaBH4) umumnya tidak dianggap sebagai katalis, melainkan sebagai zat pereduksi. Katalis adalah zat yang mempercepat reaksi kimia tanpa mengalami perubahan permanen. Natrium tetrahidroborat berubah secara kimia saat direduksi, digunakan dalam reaksi reduksi.
Reaksi sintesis dan reduksi organik umumnya menggunakan natrium tetrahidroborat sebagai sumber ion hidrida (H-). Natrium tetrahidroborat mentransfer ion hidrida ini ke molekul substrat, sehingga mereduksi gugus fungsi seperti karbonil, nitril, dan ester. Meskipun berperan sebagai zat pereduksi, natrium tetrahidroborat dapat memainkan peran sekunder sebagai akseptor proton, menjadikannya basa ringan yang dapat mempengaruhi kondisi reaksi dan mempengaruhi hasil reaksi.
Gas mudah terbakar apa yang dihasilkan jika natrium borohidrida dicampur dengan air?
Jika natrium tetrahidroborat (NaBH4) dicampur dengan air, ia mengalami hidrolisis cepat untuk membentuk natrium borohidrida terhidrasi (NaBH4.xH2O) dan gas hidrogen. Gas hidrogen yang dihasilkan mudah terbakar dan dapat menimbulkan ledakan serta bahaya kebakaran jika tidak ditangani dengan benar.
Reaksi antara natrium tetrahidroborat dan air dapat bersifat eksotermik dan menghasilkan panas, yang selanjutnya dapat mempercepat laju hidrolisis dan meningkatkan pelepasan gas hidrogen. Reaksi tersebut juga dapat menghasilkan gas dalam jumlah besar dalam waktu singkat sehingga menimbulkan risiko tekanan berlebih dan ledakan.
Oleh karena itu, penting untuk menangani natrium tetrahidroborat di lingkungan yang berventilasi baik dan menghindari paparan terhadap kelembapan atau air. Jika paparan terhadap kelembapan tidak dapat dihindari, penggunaan bahan penghilang kelembapan atau atmosfer pelindung dapat membantu meminimalkan laju hidrolisis dan pelepasan gas hidrogen.
Berapa mol kapur barus yang bereaksi dengan natrium borohidrida?
Jumlah mol kapur barus yang akan bereaksi dengan natrium tetrahidroborat (NaBH4) bergantung pada beberapa faktor, antara lain stoikiometri reaksi, konsentrasi dan kemurnian reaktan, serta kondisi reaksi. Stoikiometri reaksi dapat ditentukan dari persamaan kimia reduksi kapur barus menjadi isoborneol menggunakan natrium tetrahidroborat:
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
Berdasarkan persamaan tersebut, satu mol kapur barus bereaksi dengan 4 mol natrium tetrahidroborat. Jumlah sebenarnya kapur barus yang akan bereaksi dengan sejumlah NaBH4 akan bergantung pada konsentrasi dan kemurnian reaktan, serta kondisi reaksi seperti suhu, waktu, dan katalis.
Oleh karena itu, tanpa informasi yang lebih tepat, tidak mungkin menentukan jumlah pasti mol kapur barus yang akan bereaksi dengan natrium tetrahidroborat.
