Hidrazin atau N2H4 adalah senyawa tidak berwarna dan sangat reaktif yang terdiri dari nitrogen dan hidrogen. Ini digunakan sebagai propelan roket, dalam obat-obatan dan bahan kimia pertanian, dan sebagai zat pereduksi dalam reaksi kimia.
| Nama IUPAC | Hidrazin |
| Formula molekul | N2H4 |
| nomor CAS | 302-01-2 |
| Sinonim | diamina; Diazan; Nitrogen hidrida; Hidrazin anhidrat; Hidrazin anhidrat; Hidrazinium hidroksida; Hidrazin terhidrasi; metilhidrazin; Hidrazin simetris |
| Di ChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Struktur Lewis N2H4:
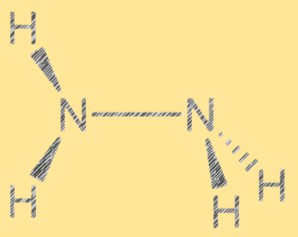
Struktur Lewis hidrazin menunjukkan susunan elektron dalam molekul. Strukturnya terdiri dari dua atom nitrogen, masing-masing dengan sepasang elektron bebas, dan empat atom hidrogen. Kedua atom nitrogen disatukan melalui ikatan kovalen tunggal dan setiap atom nitrogen juga terikat pada dua atom hidrogen. Struktur Lewis hidrazin membantu menjelaskan reaktivitas dan sifat-sifatnya.
Nama senyawa N2H4:
Nama senyawa N2H4 adalah hidrazin. Nama tersebut berasal dari fakta bahwa hidrazin merupakan senyawa yang mengandung atom hidrogen dan nitrogen. Hidrazin juga dikenal dengan berbagai nama lain, termasuk diamina, diazana, dan nitrogen hidrida.
Massa molar N2H4:
Massa molar hidrazin, dengan rumus molekul N2H4, adalah 32,04 g/mol. Ini adalah senyawa yang relatif ringan yang terdiri dari dua atom nitrogen dan empat atom hidrogen. Massa molar hidrazin yang rendah adalah salah satu alasan mengapa hidrazin umumnya digunakan sebagai bahan bakar roket, karena hidrazin memberikan rasio daya dorong terhadap berat yang tinggi.
Titik didih hidrazin:
Hidrazin memiliki titik didih 113,5 °C (236,3 °F) pada tekanan atmosfer. Titik didih yang rendah ini berarti hidrazin mudah menguap, sehingga berbahaya untuk ditangani. Jika dipanaskan, hidrazin dapat terurai menjadi gas nitrogen dan gas hidrogen, yang juga berbahaya.
Titik lebur hidrazin:
Titik leleh hidrazin adalah -51,7 °C (-61,06 °F). Artinya hidrazin berbentuk cair pada suhu dan tekanan kamar. Titik lelehnya yang rendah juga berarti ia mudah mengeras pada suhu yang lebih dingin, sehingga sulit untuk ditangani.
Kepadatan hidrazin g/ml:
Massa jenis hidrazin adalah 1,00 g/mL pada suhu dan tekanan kamar. Artinya hidrazin sedikit lebih padat daripada air, yang memiliki massa jenis 1,00 g/mL pada kondisi yang sama.
Berat molekul hidrazin:
Berat molekul hidrazin adalah 32,04 g/mol. Nilai ini digunakan untuk menghitung jumlah hidrazin yang dibutuhkan dalam reaksi kimia dan aplikasi lainnya.
Struktur hidrazin:
Struktur hidrazin terdiri dari dua atom nitrogen yang dihubungkan oleh ikatan kovalen tunggal, dengan masing-masing atom nitrogen juga dihubungkan dengan dua atom hidrogen. Hal ini memberikan hidrazin struktur molekul berbentuk V yang simetris. Struktur hidrazin memainkan peran penting dalam reaktivitas dan sifat-sifatnya.
Rumus Hidrazin:
Rumus kimia hidrazin adalah N2H4. Rumus ini menunjukkan bahwa hidrazin terdiri dari dua atom nitrogen dan empat atom hidrogen. Rumusnya digunakan untuk mewakili hidrazin dalam persamaan dan reaksi kimia.
| Penampilan | Cairan tidak berwarna sampai kuning pucat |
| Berat jenis | 1,00 gram/ml |
| Warna | Tanpa warna |
| Bau | Bau amonia |
| Masa molar | 32,04 g/mol |
| Kepadatan | 1,00 gram/ml |
| Titik fusi | -51,7°C (-61,06°F) |
| Titik didih | 113,5°C (236,3°F) |
| Titik kilat | 38°C (100°F) |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam etanol, dietil eter, kloroform |
| Tekanan uap | 72 mmHg pada 20°C |
| Kepadatan uap | 1.0 (udara=1) |
| pKa | 8 |
| pH | Dasar (pH > 7) |
Keamanan dan Bahaya Hidrazin
Hidrazin adalah senyawa yang sangat reaktif dan berbahaya sehingga memerlukan penanganan dan penyimpanan yang hati-hati. Ini beracun dan dapat menyebabkan luka bakar serius jika terkena kulit, mata atau selaput lendir. Menghirup uap hidrazin juga dapat menyebabkan iritasi pernafasan, kerusakan paru-paru, dan dalam kasus ekstrim berakibat fatal. Hidrazin juga mudah terbakar dan mudah terbakar, terutama jika bersentuhan dengan bahan tertentu seperti zat pengoksidasi. Karena bahaya ini, tindakan pencegahan keselamatan dan peralatan pelindung diri yang tepat harus digunakan saat menangani hidrazin, dan hanya boleh digunakan di area yang berventilasi baik oleh profesional berkualifikasi yang telah menerima pelatihan keselamatan yang sesuai.
| Simbol bahaya | Tengkorak dan tulang bersilang, api |
| Deskripsi Keamanan | Gunakan hanya di area yang berventilasi baik. Kenakan sarung tangan, pakaian dan pelindung mata/wajah. Hindari kontak dengan kulit, mata dan pakaian. Jauhkan dari panas, percikan api dan nyala api. |
| Nomor identifikasi PBB | PBB 2030 |
| kode HS | 282510 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun jika tertelan, terhirup dan terkena kulit. Dapat menyebabkan luka bakar parah dan kerusakan jaringan. Paparan jangka panjang dapat menyebabkan kerusakan hati dan ginjal serta berpotensi bersifat karsinogenik. |
Metode Sintesis Hidrazin
Hidrazin dapat disintesis dengan berbagai metode, bergantung pada kemurnian yang diinginkan dan aplikasi spesifik. Beberapa metode umum sintesis hidrazin adalah:
- Proses Raschig: Metode ini melibatkan reaksi amonia dan natrium hipoklorit dengan adanya katalis seperti tembaga atau nikel.
- Proses Olin-Raschig: Proses ini melibatkan reaksi urea dan asam klorida untuk menghasilkan hidrazin hidrat.
- Proses ketazine: Proses ini melibatkan reaksi aseton dengan amonia dengan adanya katalis seperti nikel Raney.
- Proses peroksida: Proses ini melibatkan reaksi hidrogen peroksida dan amonia dengan adanya katalis seperti platina atau paladium.
- Proses Bayer: Proses ini melibatkan reaksi natrium hipoklorit dengan urea dengan adanya katalis seperti tembaga atau nikel.
- Reaksi Houben-Hoesch: Reaksi ini melibatkan reaksi asam nitrat dengan amonia dengan adanya zat pereduksi seperti seng.
Setiap metode mempunyai kelebihan dan kekurangan masing-masing, dan pilihan metode akan bergantung pada faktor-faktor seperti pertimbangan biaya, hasil, kemurnian dan keamanan. Sintesis hidrazin harus dilakukan dengan hati-hati, karena hidrazin merupakan zat berbahaya dan dapat menimbulkan risiko bagi kesehatan dan keselamatan manusia jika tidak ditangani dengan benar.
Kegunaan Hidrazin
N2H4 memiliki beragam aplikasi industri, komersial, dan militer karena sifat kimianya yang unik. Beberapa kegunaan umum N2H4 meliputi:
- Perusahaan menggunakan N2H4 sebagai bahan bakar roket karena kandungan energinya yang tinggi dan stabilitasnya.
- N2H4 digunakan sebagai agen polimerisasi dalam produksi polimer tertentu, termasuk nilon dan Kevlar.
- Ahli kimia menggunakan N2H4 sebagai zat pereduksi dalam reaksi sintesis kimia, khususnya dalam produksi obat-obatan, pestisida, dan senyawa organik lainnya.
- N2H4 berfungsi sebagai reduktor pada proses pelapisan logam, khususnya pelapisan nikel.
- Instalasi pengolahan air menggunakan N2H4 sebagai pemulung oksigen, terutama pada boiler dan menara pendingin.
- Fotografer menggunakan N2H4 sebagai pengembang fotografi, khususnya dalam fotografi hitam putih.
- Produsen mobil mengandalkan N2H4 sebagai inflator pada sistem airbag mobil.
- Industri menggunakan N2H4 sebagai bahan pembersih pada peralatan dan permukaan tertentu, khususnya pada industri elektronik.
Meskipun hidrazin memiliki banyak kegunaan yang bermanfaat, hidrazin juga merupakan zat berbahaya dan harus ditangani dengan hati-hati. Tindakan pencegahan keselamatan dan peralatan pelindung diri yang tepat harus digunakan saat menangani hidrazin, dan hanya boleh digunakan oleh profesional berkualifikasi yang telah menerima pelatihan keselamatan yang sesuai.
Pertanyaan:
Berapakah bilangan oksidasi (bilangan oksidasi) N dalam N2H4?
Pada N2H4, bilangan oksidasi (bilangan oksidasi) N adalah -2. Setiap atom hidrogen mempunyai bilangan oksidasi +1, dan karena N2H4 adalah molekul netral, jumlah bilangan oksidasi semua atom harus sama dengan nol. Karena ada dua atom nitrogen dalam N2H4, bilangan oksidasi total nitrogen dalam molekul adalah -4. Oleh karena itu, bilangan oksidasi setiap atom nitrogen adalah -2, yang menyeimbangkan bilangan oksidasi atom hidrogen.
Apa nama senyawa N2H4?
Senyawa N2H4 biasa disebut hidrazin.
Berapakah perbandingan molar hidrazin (n2h4) dengan hidrogen peroksida (h2o2) dan perbandingan molar hidrazin dengan air?
Rasio molar hidrazin (N2H4) terhadap hidrogen peroksida (H2O2) dan hidrazin terhadap air dapat ditentukan dari persamaan kimia setara dari masing-masing reaksi.
Ketika hidrazin bereaksi dengan hidrogen peroksida menghasilkan gas nitrogen (N2), air (H2O), dan gas oksigen (O2) menurut persamaan setara berikut:
N2H4 + H2O2 → N2 + 2H2O + O2
Menurut persamaan ini, rasio molar hidrazin terhadap hidrogen peroksida adalah 1:1. Artinya, untuk setiap mol hidrazin yang digunakan dalam reaksi, diperlukan satu mol hidrogen peroksida.
Ketika hidrazin bereaksi dengan air, ia membentuk hidrazin hidrat, yang memiliki rumus kimia N2H4·H2O. Persamaan kimia setara untuk reaksi ini adalah:
N2H4 + H2O → N2H4·H2O
Menurut persamaan ini, rasio molar hidrazin/air adalah 1:1. Ini berarti bahwa untuk setiap mol hidrazin yang digunakan dalam reaksi, satu mol air dikonsumsi dan satu mol hidrazin hidrat dihasilkan.
