Asam sulfat (H2SO4) atau minyak vitriol merupakan asam mineral yang sangat korosif dan kuat yang biasa digunakan dalam berbagai proses industri seperti produksi pupuk, penyulingan minyak bumi dan pengolahan logam. Ini juga merupakan agen dehidrasi yang kuat.
| Nama IUPAC | Asam sulfat |
| Formula molekul | H2SO4 |
| nomor CAS | 7664-93-9 |
| Sinonim | Minyak vitriol, asam sulfat anhidrida, asam bisulfat |
| Di ChI | InChI=1S/H2O4S/c2-1(3)4/jam(H2,2,3,4)/p-1 |
Sifat asam sulfat
Formula Asam Sulfat
Rumus kimia asam sulfat adalah H2SO4, yang mewakili dua atom hidrogen, satu atom belerang, dan empat atom oksigen. Rumus ini mewakili komposisi molekul asam sulfat dan struktur kimianya.
Massa molar Asam Sulfat
Massa molar asam sulfat adalah 98,08 g/mol. Ini dihitung dengan menambahkan massa atom setiap unsur ke dalam rumus kimia asam sulfat (H2SO4).
Titik didih asam sulfat
Asam sulfat mempunyai titik didih 337,1°C. Pada suhu ini, tekanan uap cairan mencapai tekanan atmosfer dan mulai mendidih.
Titik leleh asam sulfat
Titik leleh asam sulfat adalah 10,4°C. Ini adalah cairan yang sangat kental pada suhu kamar, tetapi dapat membeku menjadi padat pada suhu yang lebih rendah.
Massa jenis asam sulfat g/ml
Massa jenis asam sulfat bervariasi dari 1,84 g/mL hingga 1,93 g/mL, tergantung konsentrasinya. Ketika konsentrasi asam sulfat meningkat, densitasnya juga meningkat.
Berat molekul asam sulfat
Berat molekul asam sulfat adalah 98,08 g/mol. Ini dihitung dengan menambahkan massa atom setiap unsur ke dalam rumus kimianya (H2SO4).
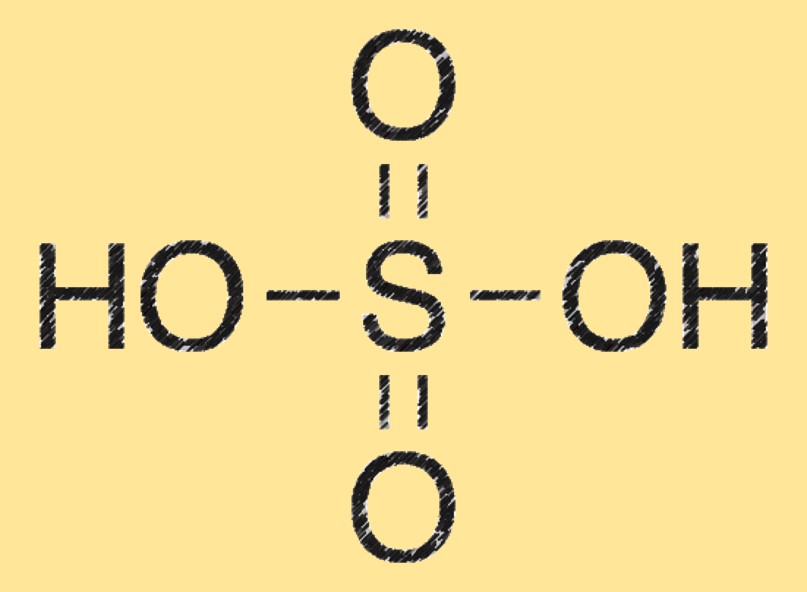
Struktur asam sulfat
Molekul asam sulfat terdiri dari dua atom hidrogen (H) yang terikat pada atom belerang (S) juga terikat pada empat atom oksigen (O). Ia memiliki geometri molekul tetrahedral dan merupakan agen dehidrasi yang kuat.
| Penampilan | Cairan bening, tidak berwarna, berminyak |
| Berat jenis | 1,84 (air = 1) |
| Warna | Tanpa warna |
| Bau | Bau menyengat dan belerang |
| Masa molar | 98,079 g/mol |
| Kepadatan | 1,835 gram/mL |
| Titik fusi | 10,5°C |
| Titik didih | 337°C |
| Titik kilat | 140°F (60°C) |
| Kelarutan dalam air | Benar-benar dapat bercampur |
| Kelarutan | Larut dalam air dan alkohol |
| Tekanan uap | 40 mmHg (20°C) |
| Kepadatan uap | 2,5 (udara = 1) |
| pKa | -3 |
| pH | Kurang dari 1 (sangat asam) |
Keamanan dan Bahaya Asam Sulfat
Asam sulfat adalah zat yang sangat korosif dan berbahaya. Kontak dengan kulit dan mata dapat menyebabkan luka bakar parah dan kebutaan. Menghirup uapnya dapat mengiritasi sistem pernapasan dan menyebabkan batuk, mengi, dan sesak napas. Bahan ini mudah terbakar dan reaktif dan harus ditangani dengan hati-hati di tempat yang berventilasi baik, menggunakan peralatan pelindung seperti sarung tangan dan pelindung mata. Tumpahan harus segera dibersihkan untuk menghindari kerusakan permukaan dan berpotensi membahayakan orang. Penyimpanan dan pelabelan yang tepat diperlukan untuk memastikan penanganan yang aman.
| Simbol bahaya | Korosif, Iritasi, Berbahaya |
| Deskripsi Keamanan | Jauhkan dari panas/percikan api/api terbuka/permukaan panas. DILARANG MEROKOK. Simpan di tempat yang berventilasi baik. Jaga agar wadah tetap tertutup rapat. Kenakan sarung tangan pelindung/pakaian pelindung/pelindung mata/pelindung wajah. |
| Nomor identifikasi PBB | UN1830 |
| kode HS | 2815.11.00 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | II |
| Toksisitas | Lisan: LD50 = 1,2 g/kg (Tikus) |
Metode sintesis asam sulfat
H2SO4 dapat disintesis dengan beberapa metode, antara lain proses kontak dan proses ruang induk.
Proses kontak adalah metode yang paling banyak digunakan untuk produksi industri asam sulfat, yang melibatkan oksidasi sulfur dioksida menjadi sulfur trioksida dan kemudian reaksi sulfur trioksida dengan air menghasilkan H2SO4.
Sebaliknya, proses ruang timbal melibatkan oksidasi sulfur dioksida dengan nitrogen dioksida dengan adanya katalis, biasanya timbal dioksida, dan kemudian mereaksikan sulfur trioksida yang dihasilkan dengan air. Kedua metode tersebut menghasilkan H2SO4 dengan tingkat kemurnian dan konsentrasi yang berbeda, yang selanjutnya dapat dimurnikan dan dipekatkan sesuai kebutuhan.
Kegunaan Asam Sulfat
H2SO4 merupakan bahan kimia serbaguna dan banyak digunakan di berbagai industri. Orang biasanya menggunakan asam sulfat dalam produksi pupuk, deterjen, pewarna dan pigmen. Ia juga berperan dalam pemurnian produk minyak bumi, pengolahan mineral dan bijih, dan produksi bahan kimia seperti asam nitrat dan sulfat. Laboratorium menggunakan H2SO4 sebagai reagen dan berfungsi sebagai katalis dalam reaksi kimia. Baterai timbal-asam menggunakan asam sulfat sebagai elektrolit, dan pembuat baja menggunakannya untuk pengawetan guna menghilangkan karat dan kerak sebelum pelapisan atau pengecatan.
Secara keseluruhan, H2SO4 memainkan peran penting dalam banyak proses industri, menjadikannya salah satu bahan kimia terpenting di dunia.
Pertanyaan:
Apakah asam sulfat termasuk asam kuat?
Ya, H2SO4 adalah asam kuat. Asam kuat adalah asam yang terdisosiasi sempurna dalam air menghasilkan ion hidrogen (H+), artinya asam kuat menyumbangkan seluruh ion hidrogennya ke dalam larutan. Dianggap sebagai salah satu asam terkuat, asam sulfat memiliki tingkat keasaman yang tinggi sehingga sangat reaktif dan korosif. Untuk menghindari bahaya terhadap manusia dan lingkungan, penanganan dan penyimpanan asam sulfat yang tepat sangatlah penting.
Untuk apa asam sulfat digunakan?
Asam sulfat banyak digunakan di berbagai industri dan aplikasi. Beberapa kegunaan H2SO4 yang paling umum meliputi:
- Produksi pupuk: Asam sulfat digunakan dalam produksi asam fosfat, yang merupakan komponen kunci dari banyak pupuk.
- Pemurnian minyak: Asam sulfat digunakan untuk menghilangkan kotoran seperti senyawa belerang dari minyak mentah selama proses pemurnian.
- Pengolahan Logam: Asam sulfat digunakan dalam pengolahan logam untuk menghilangkan karat dan kerak pada besi dan baja, serta untuk memurnikan bijih logam.
- Manufaktur: Asam sulfat digunakan dalam produksi berbagai produk, termasuk deterjen, pewarna, pigmen, dan bahan kimia lainnya.
- Baterai otomotif: Asam sulfat digunakan sebagai elektrolit dalam baterai timbal-asam, biasa digunakan pada mobil dan kendaraan lainnya.
- Reagen Laboratorium: Asam sulfat umumnya digunakan sebagai reagen laboratorium karena tingkat reaktivitasnya yang tinggi dan kemampuannya melarutkan banyak zat.
Jenis asam apa yang dimaksud dengan asam sulfat?
H2SO4 adalah asam anorganik kuat. Diklasifikasikan sebagai asam diprotik, H2SO4 menyumbangkan dua ion hidrogen (H+) ke dalam larutan, menjadikannya asam mineral kuat. Karena sifatnya yang sangat reaktif dan korosif, penanganan dan penyimpanan H2SO4 harus dilakukan dengan hati-hati agar tidak membahayakan manusia dan lingkungan. Industri banyak menggunakan asam sulfat dalam prosesnya, termasuk dalam produksi pupuk, deterjen, pewarna, pigmen dan bahan kimia lainnya, serta dalam pemurnian produk minyak bumi dan pengolahan bijih logam.
Apa rumus asam sulfat?
Rumus kimia asam sulfat adalah H2SO4.
Apa itu minyak vitriol?
Minyak vitriol adalah istilah lain untuk asam sulfat, bahan kimia yang kuat dan sangat korosif. Hal ini umumnya digunakan dalam produksi pupuk, deterjen dan pewarna, serta dalam penyulingan minyak bumi dan pengolahan bahan kimia lainnya.
