Magnesium oksida (MgO) adalah padatan bubuk putih yang digunakan sebagai bahan bangunan dan suplemen makanan. Ia juga digunakan sebagai antasida karena sifat dasarnya (basa).
| Nama IUPAC | Magnesium oksida |
| Formula molekul | MgO |
| nomor CAS | 1309-48-4 |
| Sinonim | Magnesia, Magnesit, Periklas |
| Di ChI | InChI=1S/MgO/c1-2 |
Rumus Magnesium Oksida
Rumus kimia magnesium oksida adalah MgO. Ini mewakili ion magnesium (Mg2+) dan ion oksigen (O2-). Rumusnya menunjukkan rasio unsur-unsur yang ada dalam senyawa dan digunakan untuk menulis persamaan kimia seimbang untuk reaksi yang melibatkan magnesium oksida.
Massa Molar Magnesium Oksida
Massa molar magnesium oksida adalah 40,304 g/mol. Ini dihitung dengan menjumlahkan massa atom setiap unsur yang ada dalam senyawa. Massa atom magnesium adalah 24.305 g/mol, sedangkan oksigen adalah 16.000 g/mol. Massa molar penting dalam menentukan jumlah zat yang ada dalam sampel magnesium oksida tertentu.
Titik didih magnesium oksida
Titik didih magnesium oksida adalah 2852°C. Pada suhu ini, tekanan uap zat padat menjadi sama dengan tekanan atmosfer dan mulai mendidih. Tingginya titik didih magnesium oksida disebabkan oleh sifat ioniknya, yang memerlukan sejumlah besar energi untuk memisahkan ion-ion dalam struktur kisi.
Titik Leleh Magnesium Oksida
Titik leleh magnesium oksida adalah 2800°C. Pada suhu ini, wujud padat berubah menjadi cair. Tingginya titik leleh magnesium oksida juga disebabkan oleh sifat ioniknya dan kuatnya ikatan antar ion dalam struktur jaringannya.
Massa jenis magnesium oksida g/mL
Massa jenis magnesium oksida adalah 3,58 g/mL. Nilai ini dapat digunakan untuk menentukan jumlah ruang yang ditempati oleh massa magnesium oksida tertentu. Ini adalah sifat karakteristik senyawa dan berguna dalam berbagai aplikasi.
Berat Molekul Magnesium Oksida
Berat molekul magnesium oksida adalah 40,304 g/mol. Ini adalah jumlah berat atom setiap unsur yang ada dalam senyawa. Berat molekul penting dalam menentukan jumlah zat yang ada dalam sampel magnesium oksida tertentu.
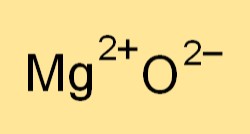
Struktur magnesium oksida
Magnesium oksida memiliki struktur kisi kristal dimana ion magnesium dikelilingi oleh ion oksigen. Ion magnesium dan oksigen disatukan oleh ikatan ionik yang kuat, yang berkontribusi terhadap tingginya titik leleh dan titik didih senyawa tersebut. Struktur kristal merupakan faktor penting dalam menentukan sifat magnesium oksida, seperti densitas dan konduktivitas termal.
| Penampilan | Padatan berbentuk tepung berwarna putih |
| Berat jenis | 3,58g/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 40,304 g/mol |
| Kepadatan | 3,58g/ml |
| Titik fusi | 2800°C |
| Titik didih | 2852°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Alkali (dasar) |
Keamanan dan Bahaya Magnesium Oksida
Magnesium oksida umumnya dianggap aman untuk dikonsumsi manusia pada dosis yang dianjurkan dan digunakan sebagai suplemen makanan dan antasida. Namun, menghirup debu magnesium oksida konsentrasi tinggi dapat menyebabkan iritasi pernafasan dan paparan jangka panjang dapat menyebabkan kerusakan paru-paru. Menelan magnesium oksida dalam jumlah besar dapat menyebabkan diare, mual, dan ketidaknyamanan perut. Penting untuk menyimpan magnesium oksida di tempat yang kering dan berventilasi baik untuk menghindari terhirupnya debu. Hindari kontak kulit dan mata dengan magnesium oksida karena dapat menyebabkan iritasi. Seperti semua bahan kimia, penting untuk mengikuti prosedur penanganan dan keselamatan yang benar saat bekerja dengan magnesium oksida untuk meminimalkan risiko cedera.
| Simbol bahaya | T/A |
| Deskripsi Keamanan | S26-S36/37/39 |
| Nomor identifikasi PBB | UN3077, Bahan berbahaya bagi lingkungan, padat, nos (magnesium oksida) |
| kode HS | 2825.90.90 |
| Kelas bahaya | 9 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah jika tertelan pada dosis yang dianjurkan, dapat menyebabkan iritasi pernafasan jika terhirup pada konsentrasi tinggi |
Metode Sintesis Magnesium Oksida
Magnesium oksida (MgO) dapat disintesis dengan beberapa metode, termasuk dekomposisi termal, presipitasi, dan proses sol-gel.
Dekomposisi termal, juga dikenal sebagai kalsinasi, melibatkan pemanasan magnesium karbonat atau hidroksida pada suhu tinggi untuk menghasilkan MgO. Metode ini umumnya digunakan dalam produksi bahan tahan api, serta dalam sintesis MgO dengan kemurnian tinggi untuk industri farmasi dan kimia.
Pengendapan adalah metode lain untuk mensintesis MgO. Metode ini melibatkan reaksi garam magnesium, seperti magnesium klorida atau sulfat, dengan larutan basa, seperti natrium hidroksida atau kalium hidroksida, untuk membentuk MgO. MgO yang diendapkan kemudian dapat disaring, dicuci dan dikeringkan untuk mendapatkan produk murni.
Proses sol-gel melibatkan hidrolisis dan kondensasi prekursor magnesium, seperti magnesium alkoksida, untuk membentuk MgO. Metode ini menawarkan keuntungan dalam memproduksi MgO dengan ukuran partikel yang seragam dan struktur kristal yang terdefinisi dengan baik, sehingga berguna untuk aplikasi dalam industri katalis, keramik, dan elektronik.
Secara keseluruhan, metode sintesis MgO akan bergantung pada kemurnian yang diinginkan, ukuran partikel, dan struktur kristal, serta tujuan penerapan produk MgO. Terlepas dari metode sintesisnya, penting untuk mengontrol kondisi reaksi secara hati-hati untuk menghindari pembentukan pengotor dan mendapatkan produk MgO berkualitas tinggi.
Kegunaan Magnesium Oksida
Magnesium oksida (magnesium oksida) memiliki beragam aplikasi karena stabilitas kimianya, konduktivitas termal yang tinggi, dan sifat isolasi listrik. Beberapa kegunaan paling umum untuk magnesium oksida meliputi:
- Magnesium oksida (MgO) memiliki kegunaan yang luas karena stabilitas kimianya, konduktivitas termal yang tinggi, dan sifat insulasi listrik.
- Industri bangunan dan konstruksi menggunakan MgO sebagai bahan tahan api dan dalam produksi bahan tahan api.
- Industri farmasi menggunakan MgO sebagai suplemen makanan dan antasida untuk menetralkan asam lambung.
- MgO berfungsi sebagai sumber magnesium dalam produksi senyawa magnesium lainnya, seperti magnesium hidroksida dan magnesium karbonat.
- Industri kimia menggunakan MgO sebagai katalis dalam berbagai reaksi, termasuk produksi karet sintetis, plastik, dan resin.
- Industri pertanian menggunakan MgO sebagai bahan pembenah tanah untuk meningkatkan kesuburan tanah dan menyediakan magnesium penting untuk pertumbuhan tanaman.
- Kemampuan MgO dalam menyerap logam berat dan zat beracun membuatnya berguna untuk perbaikan lingkungan.
- Industri keramik menggunakan MgO sebagai bahan baku dalam produksi keramik, isolator listrik, bahan tahan api dan insulasi suhu tinggi.
- Industri elektronik menggunakan MgO dalam produksi perangkat elektronik seperti kapasitor dan transistor karena konstanta dielektriknya yang tinggi dan tangen rugi-rugi yang rendah.
Secara keseluruhan, magnesium oksida adalah bahan serbaguna yang memiliki banyak kegunaan karena kombinasi unik antara sifat kimia dan fisiknya.
Pertanyaan:
Apa yang paling tepat menggambarkan senyawa seperti magnesium oksida?
Magnesium oksida (MgO) terbentuk sebagai senyawa ionik.
Magnesium logam menyumbangkan elektron ke oksigen nonlogam, menghasilkan ion magnesium bermuatan positif (Mg2+) dan ion oksida bermuatan negatif (O2-). Ion-ion ini berikatan secara ionik melalui tarikan elektrostatis yang kuat, menghasilkan struktur kristal padat.
Senyawa ionik menunjukkan titik leleh dan titik didih yang tinggi, padat pada suhu kamar, konduktivitas listrik yang baik dalam keadaan cair atau terlarut, dan tidak larut dalam sebagian besar pelarut. Karakteristik ini membedakan senyawa ionik dari senyawa molekuler, yang terbentuk melalui ikatan kovalen dan memiliki titik leleh dan titik didih yang lebih rendah, konduktivitas listrik yang buruk, dan kelarutan dalam banyak pelarut.
Senyawa ionik apa yang digunakan sebagai bahan bangunan? garam batu kapur magnesium oksida besi oksida
Batu kapur garam bukanlah senyawa ionik, tetapi magnesium oksida dan besi oksida.
Magnesium oksida (MgO) dan oksida besi digunakan sebagai bahan bangunan. MgO membentuk dinding dan partisi tahan api dan berfungsi sebagai komponen bahan tahan api untuk aplikasi suhu tinggi. Oksida besi, juga dikenal sebagai hematit, memberi warna coklat kemerahan pada batu bata, beton, dan keramik sebagai pigmen. Hematit juga berperan sebagai katalis dalam reaksi kimia dan berfungsi sebagai bahan magnetis dalam berbagai teknologi.
