Merkuri klorida adalah senyawa beracun dengan rumus HgCl2. Ini adalah padatan kristal putih yang digunakan di laboratorium sebagai reagen dan desinfektan, namun penanganan yang tepat sangat penting.
| Nama IUPAC | Merkuri(II) klorida |
| Formula molekul | HgCl2 |
| nomor CAS | 7487-94-7 |
| Sinonim | Merkuri diklorida, merkuri diklorida, merkuri biklorida, merkuri (II) diklorida |
| Di ChI | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Sifat merkuri klorida
Formula Merkuri Klorida
Rumus merkuri diklorida adalah HgCl2. Terdiri dari satu atom merkuri (Hg) dan dua atom klor (Cl). Senyawa ini juga dikenal sebagai merkuri(II) klorida, melambangkan bilangan oksidasi +2 merkuri.
Massa Molar Merkuri Klorida
Massa molar merkuri diklorida kira-kira 271,52 g/mol. Ini dihitung dengan menambahkan massa atom satu atom merkuri (200,59 g/mol) dan dua atom klor (masing-masing 35,45 g/mol).
Titik didih merkuri klorida
Merkuri diklorida memiliki titik didih sekitar 302°C (575,6°F). Pada suhu ini, merkuri diklorida padat berubah menjadi uap.
Titik leleh merkuri klorida
Titik leleh merkuri diklorida kira-kira -71°C (-95,8°F). Pada suhu ini, merkuri diklorida padat berubah menjadi cair.
Kepadatan merkuri klorida g/mL
Kepadatan merkuri diklorida kira-kira 5,4 g/mL. Kepadatan yang tinggi ini menjadikannya zat yang relatif berat.
Berat Molekul Merkuri Klorida
Berat molekul merkuri diklorida kira-kira 271,52 g/mol. Ini menunjukkan massa satu mol senyawa dan sesuai dengan jumlah berat atomnya.
Struktur merkuri klorida
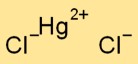
Merkuri diklorida memiliki struktur kristal. Ini terdiri dari ion merkuri bermuatan positif (Hg2+) dan ion klorida bermuatan negatif (Cl-), disatukan oleh ikatan ionik. Susunannya membentuk pola seperti kisi-kisi.
Kelarutan merkuri klorida
Merkuri diklorida memiliki kelarutan yang terbatas dalam air. Sekitar 7,7 gram merkuri diklorida dapat larut dalam 100 ml air pada suhu kamar (20°C). Kelarutannya meningkat dengan meningkatnya suhu.
Merkuri diklorida adalah zat yang sangat beracun dan harus ditangani dengan sangat hati-hati. Telah banyak digunakan dalam berbagai aplikasi, termasuk sebagai reagen di laboratorium kimia, sebagai desinfektan, dan dalam proses pelapisan listrik. Karena toksisitasnya, penting untuk mengikuti protokol keselamatan yang tepat saat menangani senyawa ini.
| Penampilan | Padatan kristal putih |
| Berat jenis | 5.4g/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 271,52 g/mol |
| Kepadatan | 5.4g/ml |
| Titik fusi | -71°C (-95,8°F) |
| Titik didih | 302°C (575,6°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Membatasi |
| Kelarutan | Larut dalam pelarut organik seperti alkohol, eter |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | 8.23 (udara = 1) |
| pKa | Tak dapat diterapkan |
| pH | Asam (dalam air) |
Keamanan dan bahaya merkuri klorida
Merkuri diklorida menimbulkan risiko keamanan yang signifikan karena toksisitasnya yang ekstrem. Kontak langsung dengan kulit atau menghirup uapnya dapat menyebabkan gangguan kesehatan yang serius. Penting untuk menanganinya dengan sangat hati-hati, menggunakan peralatan pelindung yang sesuai seperti sarung tangan dan alat bantu pernapasan. Selalu bekerja di area yang berventilasi baik untuk meminimalkan paparan. Simpan dalam wadah tertutup rapat, jauh dari bahan yang tidak kompatibel. Jika tertelan atau terpapar secara tidak sengaja, segera dapatkan bantuan medis. Metode pembuangan yang benar harus diikuti untuk menghindari kontaminasi terhadap lingkungan. Secara keseluruhan, kepatuhan yang ketat terhadap protokol keselamatan sangat penting ketika menangani merkuri diklorida.
| Simbol bahaya | Tengkorak dan tulang bersilang, bersifat korosif |
| Deskripsi Keamanan | Sangat beracun dan korosif. Gunakan dengan sangat hati-hati. Hindari kontak langsung dan menghirup asap. |
| Nomor identifikasi PBB | UN1624 (Senyawa merkuri, nos) |
| kode HS | 2852.10.10 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II (Menengah) |
| Toksisitas | Sangat beracun bagi manusia dan hewan. Tangani dengan hati-hati dan ikuti protokol keselamatan yang ketat. |
Metode sintesis merkuri klorida
Ada beberapa metode berbeda untuk mensintesis merkuri diklorida.
Pendekatan umum melibatkan reaksi logam merkuri dengan asam klorida . Dalam lingkungan yang terkendali, tambahkan merkuri ke dalam asam untuk menghasilkan merkuri diklorida dan melepaskan gas hidrogen. Persamaan kimia untuk reaksi ini adalah:
Hg + 2HCl -> HgCl2 + H2
Metode lain menggunakan reaksi antara merkuri oksida (HgO) dan asam klorida . Gabungkan oksida merkuri dengan asam untuk membentuk merkuri diklorida dan air:
HgO + 2HCl -> HgCl2 + H2O
Selain itu, merkuri diklorida dapat diproduksi dengan mereaksikan merkuri dengan gas klor:
Hg + Cl2 -> HgCl2
Ingatlah untuk melakukan sintesis merkuri diklorida hanya di bawah penutup yang berventilasi baik atau dalam kondisi terkendali karena sifatnya yang beracun dan korosif. Penanganan yang hati-hati dan tindakan pencegahan keselamatan berikut sangat penting untuk menghindari paparan berbahaya selama proses sintesis.
Kegunaan merkuri klorida
Merkuri diklorida, juga dikenal sebagai merkuri(II) klorida, telah digunakan dalam berbagai bidang karena sifatnya yang unik. Berikut beberapa kegunaan utamanya:
Reagen Laboratorium: Merkuri diklorida berfungsi sebagai reagen penting di laboratorium kimia untuk berbagai prosedur analitis dan sintetik.
Disinfektan: Sifat antimikroba yang kuat menjadikannya berharga sebagai disinfektan, terutama untuk mensterilkan peralatan dan permukaan.
Pengobatan: Meskipun terbatas karena toksisitasnya, telah digunakan dalam pengobatan tradisional untuk kondisi tertentu.
Fotografi: Di masa lalu, merkuri klorida berperan dalam fotografi awal sebagai bahan pengikat untuk mengembangkan foto.
Elektroplating: Dalam proses pelapisan listrik, individu menggunakan merkuri diklorida sebagai elektrolit untuk mengendapkan lapisan logam pada berbagai benda.
Pengawetan Kayu: Sepanjang sejarah, orang telah menggunakannya untuk mengolah kayu, melindunginya dari pembusukan dan hama.
Industri tekstil: Produsen menggunakan merkuri klorida untuk menghilangkan warna dari tekstil selama proses pewarnaan.
Kimia Analitik: Ahli kimia menggunakannya untuk tes dan reaksi spesifik dalam analisis kimia.
Sintesis organik khusus: dapat diterapkan dalam reaksi sintesis organik tertentu.
Fungisida dan Algaecide: Petani secara aktif menggunakannya sebagai fungisida dan algaesida untuk mengendalikan pertumbuhan jamur dan alga di bidang pertanian.
Pertanyaan:
Q: Apakah HgCl2 larut atau tidak larut dalam air?
A: HgCl2 sedikit larut dalam air.
Q: Berapakah kation dan anion dari senyawa HgCl2?
A: Kationnya adalah Hg2+ (merkuri) dan anionnya adalah Cl- (klorida).
Q: Apakah HgCl2 bersifat ionik atau kovalen?
Jawaban: HgCl2 merupakan senyawa ionik.
T: Bagaimana cara membuat Merkuri Klorida di Minecraft?
A: Di Minecraft, Merkuri Diklorida dapat disintesis dengan menggabungkan Merkuri dan Klorin dalam meja kerajinan.
T: Untuk apa merkuri klorida digunakan?
A: Merkuri diklorida digunakan di laboratorium sebagai reagen dan desinfektan.
T: Siapa yang menemukan merkuri klorida?
J: Penemuan dan penggunaan pertama merkuri diklorida sudah ada sejak zaman kuno, sehingga tidak memiliki inventarisasi khusus.
Q: Bagaimana cara membuat Merkuri Klorida di Minecraft Education Edition?
A: Di Minecraft Education Edition, Merkuri Diklorida dapat dibuat dengan menggabungkan merkuri dan klorin dalam meja kerajinan, seperti pada versi standar Minecraft.
T: Apa itu merkuri klorida?
A: Merkuri diklorida adalah senyawa beracun dengan rumus kimia HgCl2.
Q: Apakah HgCl2 termasuk benda padat?
A: Ya, HgCl2 berbentuk padat pada suhu kamar.
Q: Apa nama yang benar untuk HgCl2 dalam penamaan ionik?
J: Nama HgCl2 yang benar dalam penamaan ionik adalah merkuri(II) diklorida.
T: Apa nama HgCl2?
A: Nama HgCl2 adalah merkuri diklorida.
Q: 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), berapa hukum laju reaksinya?
A: Hukum laju: Laju = k[HgCl2]^2[C2O4^2-] (orde kedua terhadap HgCl2 dan orde pertama terhadap C2O4^2-).
