Magnesium sulfit (MgSO3) merupakan senyawa yang tersusun dari ion magnesium dan sulfit. Ini umumnya digunakan sebagai pengawet makanan dan antioksidan dalam industri makanan.
| Nama IUPAC | Magnesium sulfit |
| Formula molekul | MgSO3 |
| nomor CAS | 7757-88-2 |
| Sinonim | Magnesium sulfonat, magnesium sulfur trioksida, E-536 |
| Di ChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/jam;(H2,1,2,3)/q+2;/p-2 |
Sifat magnesium sulfit
Formula Magnesium Sulfit
Magnesium sulfit memiliki rumus kimia MgSO3 yang menunjukkan bahwa ia tersusun dari satu atom magnesium, satu atom belerang, dan tiga atom oksigen. Ion sulfit merupakan ion poliatomik dengan rumus SO3 2-, terdiri dari atom belerang pusat yang terikat pada tiga atom oksigen. Ion Mg bermuatan +2, sedangkan ion SO3 2- bermuatan -2 sehingga senyawa tersebut netral secara listrik.
Massa Molar Magnesium Sulfit
Massa molar MgSO3 adalah 104,37 g/mol, yang setara dengan jumlah massa atom satu atom magnesium, satu atom belerang, dan tiga atom oksigen. Nilai ini penting untuk menghitung jumlah MgSO3 yang diperlukan untuk suatu reaksi tertentu, serta menentukan stoikiometri persamaan kimia.
Titik didih magnesium sulfit
MgSO3 terurai sebelum mencapai titik didihnya, sehingga tidak mempunyai titik didih tertentu. Sebaliknya, ia mulai terurai menjadi magnesium oksida dan sulfur dioksida pada suhu di atas 700°C. Proses penguraian ini dapat dipercepat dengan paparan udara atau kelembapan, sehingga MgSO3 merupakan senyawa yang relatif tidak stabil.
Titik leleh magnesium sulfit
Titik leleh MgSO3 kira-kira 150°C. Pada suhu ini, senyawa tersebut mulai terurai menjadi magnesium oksida dan sulfur dioksida. Proses penguraiannya bersifat eksotermik, artinya melepaskan panas. Titik leleh MgSO3 penting untuk memahami sifat-sifatnya sebagai padatan, seperti kelarutan dan struktur kristalnya.
Massa jenis magnesium sulfit g/mL
Kepadatan MgSO3 bervariasi tergantung pada bentuk fisiknya, tetapi umumnya berkisar antara 2,5 hingga 3,0 g/mL. Nilai ini penting untuk menentukan massa volume MgSO3 tertentu, serta untuk memahami perilakunya dalam larutan. Massa jenis MgSO3 juga dapat digunakan untuk menghitung massa jenisnya, yaitu ukuran massa jenis relatifnya dibandingkan dengan air.
Berat Molekul Magnesium Sulfit
Berat molekul MgSO3 adalah 104,37 g/mol. Nilai ini penting untuk memahami sifat fisik dan kimia suatu senyawa, serta untuk menghitung jumlah MgSO3 yang diperlukan untuk suatu reaksi tertentu. Berat molekul MgSO3 dapat dihitung dengan menjumlahkan berat atom satu atom magnesium, satu atom sulfur, dan tiga atom oksigen.
Struktur magnesium sulfit
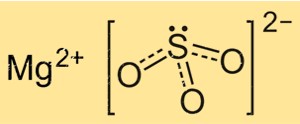
Struktur MgSO3 didasarkan pada kisi kristal ion Mg+2 dan ion SO3 2-. Ion Mg+2 dikelilingi oleh enam atom oksigen, tersusun secara oktahedral, sedangkan ion SO3 2- terikat dengan ion magnesium melalui dua atom oksigen. Struktur kristal MgSO3 penting untuk memahami sifat fisik dan kimianya, seperti kelarutan dan reaktivitasnya.
Kelarutan magnesium sulfit
MgSO3 sulit larut dalam air, dengan kelarutan sekitar 7,5 g/L pada suhu kamar. Kelarutan yang rendah ini disebabkan oleh struktur kristal senyawa yang menyulitkan molekul air untuk menembus dan larut dalam padatan. MgSO3 lebih larut dalam larutan asam karena asam dapat bereaksi dengan ion sulfit membentuk bisulfit dan asam sulfat. Kelarutan MgSO3 penting untuk memahami perilakunya dalam larutan, serta menentukan efektivitasnya sebagai pengawet makanan dan antioksidan.
| Penampilan | Bubuk putih atau kristal |
| Berat jenis | 2.5 – 3.0 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 104,37 g/mol |
| Kepadatan | 2,5 hingga 3,0 g/ml |
| Titik fusi | Sekitar 150°C |
| Titik didih | Terurai di atas 700°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedikit larut, kira-kira 7,5 g/L pada suhu kamar |
| Kelarutan | Lebih larut dalam larutan asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Magnesium Sulfit
MgSO3 tidak dianggap sebagai zat yang sangat berbahaya. Namun, bahan ini dapat menyebabkan iritasi pada mata, kulit, dan saluran pernafasan jika terkena atau terhirup. Menelan MgSO3 dapat menyebabkan iritasi gastrointestinal dan kemungkinan muntah. Paparan konsentrasi tinggi dalam waktu lama dapat menyebabkan kerusakan paru-paru atau iritasi pernafasan. Oleh karena itu penting untuk menangani MgSO3 dengan hati-hati, memakai alat pelindung diri yang sesuai dan menghindari menghirup debu atau asap. MgSO3 harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel seperti oksidan kuat, asam, dan basa.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Hindari menghirup debu atau asap. Kenakan alat pelindung diri yang sesuai. |
| Nomor identifikasi PBB | Tidak diatur |
| kode HS | 2833.29 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah, dapat menyebabkan iritasi pada mata, kulit dan saluran pernapasan jika terkena atau terhirup. Tertelan dapat menyebabkan iritasi gastrointestinal dan kemungkinan muntah. Paparan konsentrasi tinggi dalam waktu lama dapat menyebabkan kerusakan paru-paru atau iritasi pernafasan. |
Metode sintesis magnesium sulfit
MgSO3 dapat disintesis dengan berbagai metode, seperti reaksi asam sulfat atau gas sulfur dioksida dengan magnesium oksida atau magnesium hidroksida.
Dalam salah satu metode, reaksi magnesium oksida dengan air membentuk magnesium hidroksida , yang kemudian bereaksi dengan asam sulfat menghasilkan MgSO3.
Metode lain melibatkan mereaksikan magnesium hidroksida dengan gas sulfur dioksida dengan adanya air untuk membentuk MgSO3.
Dalam metode lain, mereaksikan magnesium sulfat dengan natrium sulfit atau kalium sulfit dapat mensintesis MgSO3. Reaksi ini menghasilkan endapan MgSO3, yang dapat diisolasi oleh peneliti melalui penyaringan dan pengeringan.
Reaksi magnesium asetat dengan gas sulfur dioksida dengan adanya air dapat menghasilkan MgSO3. Kemudian cuci dan keringkan endapan MgSO3 yang dihasilkan.
Metode ini dapat digunakan untuk memproduksi MgSO3 untuk berbagai aplikasi, termasuk produksi kertas dan pulp, pengolahan makanan dan minuman, serta pengolahan air.
Kegunaan Magnesium Sulfit
MgSO3 memiliki berbagai kegunaan di berbagai industri. Berikut adalah beberapa kegunaan umum:
- Pengolahan Air: Digunakan sebagai pemulung oksigen dalam pengolahan air boiler untuk mencegah korosi dan pembentukan kerak.
- Pengolahan makanan dan minuman: Digunakan sebagai pengawet dan antioksidan dalam pengolahan makanan dan minuman untuk memperpanjang umur simpan dan mencegah pembusukan.
- Produksi Pulp dan Kertas: Digunakan sebagai bahan pemutih pada industri pulp dan kertas untuk meningkatkan kecerahan dan warna produk kertas.
- Manufaktur tekstil: Digunakan sebagai zat pereduksi dalam manufaktur tekstil untuk menghilangkan kelebihan oksigen dan meningkatkan kualitas produk jadi.
- Pertanian: Digunakan sebagai semprotan daun untuk meningkatkan pertumbuhan tanaman dan meningkatkan hasil panen.
- Obat: Digunakan dalam pengobatan tradisional karena sifat antioksidan dan anti-inflamasinya.
- Kosmetik: Digunakan dalam kosmetik sebagai pengemulsi, penstabil dan pengatur pH.
- Kegunaan lain: Juga digunakan dalam produksi perekat, cat dan pelapis, serta proses pengolahan air limbah.
Pertanyaan:
T: Apa rumus magnesium sulfit?
A: Rumus magnesium sulfit adalah MgSO3.
Q: Berapa banyak magnesium sulfit dalam sampel 2,4 mol?
A: Dalam sampel 2,4 mol MgSO3, terdapat 2,4 mol MgSO3.
Q: Berapa persentase massa setiap unsur dalam 1 mol magnesium sulfit?
A: Dalam satu mol magnesium sulfit, persentase massa magnesium adalah 32,44%, belerang 29,44%, dan oksigen 38,12%.
T: Apakah magnesium sulfit menghentikan kram otot?
J: Tidak ada bukti ilmiah yang menunjukkan bahwa MgSO3 dapat menghentikan kram otot. Namun, magnesium sulfat (garam Epsom) telah digunakan untuk tujuan ini.
T: Apa efek penambahan magnesium sulfit pada reaksi?
A: Penambahan MgSO3 dapat berperan sebagai zat pereduksi pada reaksi tertentu dengan menghilangkan oksigen. Ini juga dapat bertindak sebagai pengawet dan antioksidan dalam aplikasi tertentu.
T: Apakah magnesium sulfit bersifat ionik atau molekuler?
Jawaban: MgSO3 merupakan senyawa ionik.
