Magnesium peroksida (MgO2) adalah senyawa yang terbuat dari magnesium dan oksigen. Ini biasanya digunakan di bidang pertanian sebagai sumber oksigen yang dilepaskan secara lambat dan sebagai bahan perbaikan tanah untuk meningkatkan pertumbuhan tanaman.
| Nama IUPAC | magnesium peroksida |
| Formula molekul | MgO2 |
| nomor CAS | 14452-57-4 |
| Sinonim | Magnesium dioksida, magnesium; peroksida, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| Di ChI | InChI=1S/Mg.2O2/jam;2*1H/q+2;;/p-2 |
Sifat magnesium peroksida
Rumus Magnesium Peroksida
Rumus kimia magnesium peroksida adalah MgO2. Artinya satu molekul magnesium peroksida mengandung satu atom magnesium dan dua atom oksigen. Rumusnya penting karena dapat mengidentifikasi jenis dan jumlah atom yang ada dalam senyawa dan membantu menentukan stoikiometri reaksi kimia yang melibatkan magnesium peroksida.
Massa Molar Magnesium Peroksida
MgO2 memiliki massa molar 56,304 g/mol. Artinya satu mol MgO2 mengandung 56,304 gram senyawa tersebut. Massa molar merupakan sifat penting MgO2 karena membantu menentukan berapa banyak zat yang dibutuhkan untuk reaksi kimia.
Titik didih magnesium peroksida
MgO2 tidak mempunyai titik didih tertentu karena ia terurai sebelum mendidih. Ketika dipanaskan, ia terurai menjadi magnesium oksida dan gas oksigen. Sifat MgO2 ini menjadikannya berguna sebagai sumber oksigen dalam berbagai aplikasi.
Titik leleh magnesium peroksida
MgO2 memiliki titik leleh 223°C. Artinya pada suhu di atas 700°C, senyawa padat berubah menjadi cair. Titik leleh merupakan sifat penting MgO2 karena menentukan bagaimana senyawa berperilaku ketika terkena suhu tinggi.
Massa jenis magnesium peroksida g/mL
Massa jenis MgO2 adalah 2,41 g/mL. Artinya satu mililiter MgO2 beratnya 2,41 gram. Massa jenis merupakan sifat penting MgO2 karena membantu menentukan massa suatu volume senyawa.
Berat Molekul Magnesium Peroksida
Berat molekul MgO2 adalah 56,304 g/mol. Artinya satu molekul MgO2 mempunyai massa sebesar 56.304 satuan massa atom. Berat molekul merupakan sifat penting MgO2 karena membantu menentukan berapa banyak zat yang dibutuhkan untuk reaksi kimia.
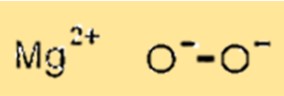
Struktur magnesium peroksida
MgO2 mempunyai struktur kristal dengan ion magnesium menempati situs oktahedral struktur kisi dan ion oksigen menempati situs tetrahedral. Struktur kristal ini penting karena menentukan sifat fisik dan kimia MgO2.
| Properti | Nilai |
| Penampilan | bubuk putih |
| Berat jenis | 3,15 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 56,304 g/mol |
| Kepadatan | 2,41 gram/ml |
| Titik fusi | 223°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Magnesium Peroksida
MgO2 umumnya dianggap aman bila ditangani dan digunakan dengan benar. Namun, bahan ini dapat menyebabkan iritasi pada kulit, mata, dan sistem pernapasan. Penelanan dalam jumlah besar dapat menyebabkan iritasi gastrointestinal, muntah dan diare. Penting untuk menghindari menghirup bedak dan mengenakan pakaian serta peralatan pelindung saat menanganinya. MgO2 tidak mudah terbakar atau meledak, namun dapat bereaksi dengan bahan kimia tertentu seperti asam dan oksidan kuat. Penyimpanan dan penanganan yang tepat diperlukan untuk menghindari reaksi yang tidak disengaja. Jika terpapar atau tertelan, segera dapatkan bantuan medis.
| Simbol bahaya | Oh, Xi |
| Deskripsi Keamanan | Magnesium peroksida dapat menyebabkan iritasi kulit dan mata, serta iritasi saluran pernapasan jika terhirup. Ini mungkin berbahaya jika tertelan atau terkena kulit dan dapat menyebabkan kerusakan mata yang serius. Ada juga risiko kebakaran jika terkena panas, nyala api, atau oksidan. |
| Nomor identifikasi PBB | UN1479 |
| kode HS | 282910 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Magnesium peroksida dapat menyebabkan iritasi kulit dan mata, serta iritasi saluran pernapasan jika terhirup. Ini mungkin berbahaya jika tertelan atau terkena kulit dan dapat menyebabkan kerusakan mata yang serius. Ada juga risiko kebakaran jika terkena panas, nyala api, atau oksidan. |
Metode sintesis magnesium peroksida
Ada beberapa metode sintesis MgO2, yang masing-masing mempunyai kelebihan dan kekurangan.
Salah satu metode melibatkan reaksi antara MgO dan hidrogen peroksida . Caranya, Anda mencampurkan MgO dengan sedikit air hingga membentuk pasta, lalu menambahkan hidrogen peroksida sambil mengaduk campuran tersebut. Produk yang dihasilkan adalah MgO2 dan air.
Metode lain melibatkan reaksi antara Mg(OH)2 dan hidrogen peroksida . Ahli kimia melarutkan Mg(OH)2 dalam air hingga membentuk larutan, kemudian mengaduk campuran sambil menambahkan hidrogen peroksida secara perlahan. Produk yang dihasilkan adalah MgO2 dan air.
Metode ketiga melibatkan reaksi langsung antara logam magnesium dan gas oksigen pada suhu tinggi. Metode ini memerlukan peralatan khusus dan tidak umum digunakan seperti metode lainnya.
Kegunaan Magnesium Peroksida
MgO2 memiliki berbagai kegunaan di berbagai industri, antara lain:
- Aplikasi Lingkungan – Digunakan sebagai senyawa pelepas oksigen dalam remediasi tanah dan air tanah untuk memecah polutan.
- Pertanian – Digunakan sebagai pupuk dan kondisioner tanah karena sifat pelepasan oksigennya yang lambat sehingga meningkatkan pertumbuhan tanaman.
- Medis – Digunakan dalam beberapa formulasi pasta gigi sebagai zat pemutih dan oksigenasi untuk kesehatan mulut.
- Manufaktur Bahan Kimia – Digunakan dalam produksi bahan kimia khusus seperti epoksi, perasid, dan perester.
- Pengolahan Makanan – Digunakan sebagai bahan pemutih pada tepung dan produk makanan lainnya.
- Industri Tekstil – Digunakan sebagai bahan pemutih dalam produksi tekstil.
- Pengolahan Air – Digunakan untuk memurnikan air dengan melepaskan oksigen dan memecah senyawa organik.
Pertanyaan:
T: Untuk apa magnesium peroksida digunakan?
A: MgO2 digunakan di berbagai industri, seperti aplikasi lingkungan, pertanian, sektor medis, manufaktur kimia, pengolahan makanan, industri tekstil dan pengolahan air.
T: Produk apa yang dihasilkan saat Anda mencampurkan hidrogen peroksida dan magnesium sulfat?
A: Ketika H2O2 dan magnesium sulfat dicampur, produk yang terbentuk adalah MgO2, air, dan gas oksigen.
T: Apakah magnesium peroksida digunakan di laboratorium?
A: Ya, MgO2 digunakan di laboratorium untuk berbagai keperluan seperti reaksi kimia, pengolahan air dan sanitasi lingkungan.
T: Apakah magnesium memecah hidrogen peroksida?
A: Magnesium tidak memecah H2O2 dengan sendirinya. Namun magnesium dapat bereaksi dengan H2O2 dengan adanya katalis, seperti kalium iodida, untuk melepaskan gas oksigen.
T: Manakah dari berikut ini yang bukan merupakan satuan rumus yang benar? k2o mgo2 al2o3 sro
A: Mgo2 bukanlah satuan rumus yang benar. Satuan rumus yang benar untuk magnesium oksida adalah MgO.
T: Apa produk dari reaksi gabungan ini? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
A: Produk yang terbentuk dari reaksi gabungan mgo dan co2 adalah mgco3.
Q: Mgo2 cair, gas atau padat?
Jawaban: Mgo2 adalah senyawa padat.
