Magnesium karbonat (MgCO3) merupakan zat tepung berwarna putih yang biasa digunakan sebagai antasida dan pencahar. Hal ini juga ditemukan dalam kosmetik dan pasta gigi tertentu. Magnesium karbonat membantu menetralkan kelebihan asam lambung dan meredakan sembelit.
| Nama IUPAC | magnesium karbonat |
| Formula molekul | MgCO3 |
| nomor CAS | 546-93-0 |
| Sinonim | Magnesit, Magnesia carbonica, garam magnesium, (MgCO3) |
| Di ChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Sifat magnesium karbonat
Formula Magnesium Karbonat
Rumus kimia magnesium karbonat adalah MgCO3. Rumus ini menunjukkan bahwa magnesium karbonat mengandung satu ion Mg+2 dan satu ion CO3 2-. Ion CO3 2 terdiri dari satu atom C dan tiga atom O. Rumus kimia magnesium karbonat merupakan sifat penting karena mengidentifikasi komposisi magnesium karbonat dan unsur penyusunnya.
Massa Molar Magnesium Karbonat
Massa molar MgCO3 adalah 84,31 g/mol. Nilai ini diperoleh dengan menjumlahkan massa atom atom magnesium, karbon, dan oksigen dalam satu mol MgCO3. Massa molar merupakan sifat fisik MgCO3 yang penting karena digunakan dalam berbagai perhitungan seperti menentukan jumlah mol MgCO3 dalam sampel tertentu.
Titik didih magnesium karbonat
MgCO3 tidak memiliki titik didih yang pasti karena ia terurai sebelum mencapai titik didihnya. Saat dipanaskan, MgCO3 terurai membentuk magnesium oksida dan karbon dioksida. Penguraian MgCO3 terjadi pada suhu sekitar 350°C.
Titik lebur magnesium karbonat
Titik leleh MgCO3 adalah 990°C. Pada suhu ini, MgCO3 meleleh dan mengalami dekomposisi membentuk magnesium oksida dan karbon dioksida. Titik leleh MgCO3 merupakan sifat fisik yang penting karena menentukan suhu di mana MgCO3 dapat dicairkan dan diproses.
Kepadatan Magnesium Karbonat g/mL
Massa jenis MgCO3 adalah 2,958 g/mL. Nilai ini diperoleh dengan membagi massa satu mol MgCO3 dengan volumenya. Massa jenis MgCO3 merupakan sifat fisik yang penting karena digunakan dalam berbagai aplikasi seperti menentukan daya apung MgCO3 dalam larutan tertentu.
Berat Molekul Magnesium Karbonat
Berat molekul MgCO3 adalah 84,31 g/mol. Nilai ini diperoleh dengan menjumlahkan massa atom atom magnesium, karbon, dan oksigen dalam molekul MgCO3. Berat molekul MgCO3 merupakan sifat fisik yang penting karena digunakan dalam berbagai perhitungan seperti menentukan jumlah MgCO3 yang diperlukan untuk suatu reaksi kimia tertentu.
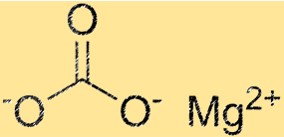
Struktur magnesium karbonat
MgCO3 memiliki struktur kristal trigonal. Ion magnesium terletak di tengah struktur dan dikelilingi oleh enam ion karbonat. Ion karbonat tersusun dalam pola heksagonal di sekitar ion magnesium. Struktur kristal MgCO3 merupakan sifat penting karena menentukan sifat fisik dan kimianya.
| Penampilan | Padatan putih |
| Kepadatan spesifik | 2,958 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 84,31 g/mol |
| Kepadatan | 2,958 gram/ml |
| Titik fusi | 990°C |
| Titik didih | Terurai sebelum mencapai titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 0,02 g/L (15°C) |
| Kelarutan | Larut dalam asam, tidak larut dalam air |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 10.3 |
| pH | 9.2-10.2 |
Keamanan dan bahaya magnesium karbonat
MgCO3 dianggap sebagai senyawa yang aman. Itu tidak mudah terbakar, meledak atau beracun. Namun, seperti senyawa kimia lainnya, senyawa ini harus ditangani dengan hati-hati. Menghirup debu MgCO3 dapat menyebabkan iritasi pernafasan. Saat menangani MgCO3, disarankan untuk memakai alat pelindung diri yang sesuai seperti sarung tangan dan kacamata pengaman. MgCO3 sebaiknya disimpan di tempat sejuk dan kering, jauh dari sumber panas dan api. MgCO3 yang tumpah harus segera dibersihkan dan dibuang dengan benar. Penting untuk mengikuti tindakan pencegahan keselamatan yang tepat saat menangani MgCO3 untuk menghindari potensi bahaya.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tidak tergolong berbahaya |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2836.60.00 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah, tidak dianggap sebagai risiko kesehatan yang signifikan bila ditangani dengan benar |
Metode sintesis magnesium karbonat
Ada beberapa metode untuk mensintesis MgCO3, termasuk presipitasi dan dekomposisi termal.
Untuk membentuk MgCO3 menggunakan metode pengendapan, Anda menambahkan garam magnesium larut (seperti magnesium klorida atau magnesium nitrat) ke dalam larutan yang mengandung karbonat larut (seperti natrium karbonat atau magnesium nitrat). amonium karbonat). Kemudian aduk campuran yang dihasilkan dan diamkan. Hal ini menyebabkan MgCO3 mengendap keluar dari larutan. Setelah itu saring endapannya, cuci bersih dan keringkan.
Untuk memperoleh MgCO3 dengan metode dekomposisi termal, magnesium hidroksida atau magnesium oksida dipanaskan sambil memasukkan karbon dioksida. Reaksi ini mengarah pada pembentukan MgCO3 dan uap air. Langkah selanjutnya adalah mengumpulkan, memurnikan dan mengeringkan MgCO3.
Metode lain untuk mensintesis MgCO3 adalah dengan mereaksikan magnesium sulfat dan natrium karbonat . Air melarutkan kedua senyawa tersebut kemudian mencampurkannya sehingga menyebabkan MgCO3 mengendap keluar dari larutan. Prosesnya kemudian mengumpulkan, mencuci dan mengeringkan endapan.
Kegunaan Magnesium Karbonat
MgCO3 adalah senyawa serbaguna dengan berbagai kegunaan di berbagai industri. Berikut beberapa kegunaannya:
- Suplemen makanan: Digunakan sebagai suplemen makanan karena kemampuannya menyediakan magnesium esensial bagi tubuh.
- Antasida: Digunakan sebagai antasida untuk mengobati sakit maag dan gangguan pencernaan.
- Aplikasi Industri: Digunakan dalam beberapa aplikasi industri, seperti produksi keramik, kaca dan semen.
- Kosmetik: Digunakan dalam kosmetik sebagai bahan pembengkakan, penyerap dan kekeruhan.
- Flame Retardant: Digunakan sebagai penghambat api dalam beberapa aplikasi, termasuk bahan isolasi, tekstil dan plastik.
- Farmasi: Digunakan dalam produksi berbagai produk farmasi, seperti obat pencahar dan antasida.
- Industri makanan: Digunakan sebagai bahan tambahan makanan untuk mengatur keasaman produk makanan dan sebagai bahan anti-caking.
- Peralatan olahraga: digunakan pada peralatan olahraga, seperti kapur gym, untuk meningkatkan cengkeraman dan mencegah tergelincir.
Pertanyaan:
T: Apakah magnesium karbonat larut dalam air?
A: MgCO3 memiliki kelarutan yang rendah dalam air. Pada suhu kamar, hanya sekitar 0,02 gram MgCO3 yang dapat larut dalam 100 ml air.
T: Apakah MgCO3 dapat larut?
A: MgCO3 memiliki kelarutan yang rendah dalam air, artinya tidak terlalu larut.
Q: Apa yang terbentuk jika asam asetat dan MgCO3 bereaksi?
A: Ketika asam asetat dan MgCO3 bereaksi, mereka membentuk magnesium asetat, air dan karbon dioksida. Persamaan kimia setara untuk reaksi ini adalah MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
Q: Kelarutan molar MgCO3 adalah 1,8 × 10–4 mol/L. Berapakah Ksp senyawa tersebut?
A: Nilai Ksp MgCO3 menggunakan kelarutan molar:
Ksp = [Mg2+][CO32-], dimana [Mg2+] sama dengan kelarutan molar, dan [CO32-] juga sama dengan kelarutan molar. Oleh karena itu, Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
T: Manakah dari produk berikut yang terbentuk selama penguraian MgCO3?
A: Ketika MgCO3 terurai, ia membentuk magnesium oksida (MgO) dan karbon dioksida (CO2).
Q: Apa persamaan kimia setara untuk reaksi yang digunakan untuk menghitung ΔH°f MgCO3(s)?
A: Persamaan reaksi kimia setara yang digunakan untuk menghitung entalpi pembentukan standar (ΔH°f) MgCO3(s) adalah: Mg(s) + CO2(g) → MgCO3(s).
