Magnesium fosfat (Mg3(PO4)2) merupakan senyawa yang tersusun dari ion magnesium dan fosfat. Ini memainkan peran penting dalam banyak proses biologis seperti sintesis DNA, fungsi saraf dan kontraksi otot.
| Nama IUPAC | Magnesium Fosfat |
| Formula molekul | Mg3(PO4)2 |
| nomor CAS | 7757-87-1 |
| Sinonim | Trimagnesium fosfat, trimagnesium ortofosfat, magnesium ortofosfat, magnesium fosfat tersier, magnesium fosfat tribasa |
| Di ChI | InChI=1S/2Mg.3H3O4P/c;;3 1-5(2,3)4/jam;;3 (H3,1,2,3,4)/q2*+2;;;/p-6 |
Sifat magnesium fosfat
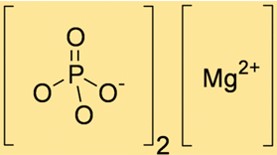
Formula Magnesium Fosfat
Rumus kimia magnesium fosfat adalah Mg3(PO4)2 yang menunjukkan bahwa magnesium fosfat mengandung tiga ion Mg+2 dan dua ion PO43-. Rumus ini penting dalam perhitungan stoikiometri dan membantu menentukan jumlah reaktan dan produk yang tepat dalam reaksi kimia yang melibatkan Mg3(PO4)2.
Massa Molar Magnesium Fosfat
Mg3(PO4)2 memiliki massa molar 262,86 g/mol. Nilai ini mewakili massa satu mol senyawa Mg3(PO4)2 yang merupakan kombinasi tiga ion Mg+2 dan dua ion PO4-. Massa molar merupakan properti penting yang digunakan dalam perhitungan stoikiometri untuk menentukan jumlah Mg3(PO4)2 yang dibutuhkan dalam berbagai reaksi kimia.
Titik didih magnesium fosfat
Mg3(PO4)2 tidak memiliki titik didih tertentu karena terurai sebelum mencapai titik didihnya. Pada suhu tinggi, Mg3(PO4)2 terurai menjadi magnesium oksida dan fosfor pentoksida, yang memiliki titik didih masing-masing 3.600°C dan 300°C. Suhu penguraian Mg3(PO4)2 bergantung pada berbagai faktor seperti konsentrasi, laju pemanasan dan tekanan.
Titik Leleh Magnesium Fosfat
Mg3(PO4)2 memiliki titik leleh 1188°C. Pada suhu tersebut, senyawa mengalami perubahan fasa dari padat menjadi cair. Titik leleh Mg3(PO4)2 dipengaruhi oleh berbagai faktor antara lain tekanan, pengotor dan struktur kristal.
Massa jenis magnesium fosfat g/mL
Kepadatan Mg3(PO4)2 bervariasi tergantung pada struktur kristal dan kondisi pengukurannya. Bentuk Mg3(PO4)2 yang paling umum, tri-Mg3(PO4)2, memiliki kepadatan 2,195 g/mL. Nilai densitas sangat penting untuk menentukan massa Mg3(PO4)2 yang dibutuhkan untuk mencapai volume tertentu dalam berbagai aplikasi.
Berat Molekul Magnesium Fosfat
Mg3(PO4)2 memiliki berat molekul 262,86 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom ion Mg dan PO43- yang ada dalam senyawa. Berat molekul Mg3(PO4)2 berguna dalam menentukan jumlah Mg3(PO4)2 yang dibutuhkan dalam berbagai reaksi kimia.
Struktur magnesium fosfat
Mg3(PO4)2 memiliki struktur kristal yang bervariasi tergantung pada metode pembuatan dan kondisi. Bentuk paling umum adalah tri-Mg3(PO4)2, yang memiliki struktur kristal terdiri dari ion Mg+2 dan ion PO43- yang tersusun dalam kisi heksagonal. Struktur kristal mempengaruhi sifat fisik dan kimia Mg3(PO4)2.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 2.195 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 262,86 g/mol |
| Kepadatan | 2,195 gram/ml |
| Titik fusi | 1188°C |
| Titik didih | Terurai sebelum titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 7.2 |
| pH | 8-9 (larutan 10%) |
Keamanan dan bahaya magnesium fosfat
Mg3(PO4)2 umumnya dianggap aman dan tidak beracun. Bahan ini tidak diklasifikasikan sebagai bahan berbahaya dan tidak menimbulkan risiko signifikan terhadap kesehatan manusia atau lingkungan. Namun, paparan debu Mg3(PO4)2 konsentrasi tinggi dalam waktu lama dapat menyebabkan iritasi pernafasan. Menelan Mg3(PO4)2 dalam jumlah besar dapat menyebabkan iritasi gastrointestinal dan mual. Penting untuk menangani Mg3(PO4)2 dengan hati-hati dan memakai alat pelindung diri yang sesuai saat menangani senyawa dalam jumlah besar. Tumpahan atau kebocoran apa pun harus segera dibersihkan untuk menghindari risiko tergelincir atau terjatuh.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tidak tergolong berbahaya |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2835.29.10 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Tidak beracun pada konsentrasi normal |
Metode sintesis magnesium fosfat
Beberapa metode yang dapat digunakan untuk mensintesis Mg3(PO4)2 antara lain pengendapan, reaksi magnesium oksida dengan asam fosfat , dan reaksi magnesium hidroksida dengan asam fosfat.
Proses pengendapan melibatkan penambahan garam fosfat terlarut, seperti Na3PO4, ke dalam larutan yang mengandung garam Mg+2 terlarut, seperti MgCl2 atau magnesium sulfat. Kemudian pencampuran kedua larutan menghasilkan endapan Mg3(PO4)2 yang dapat dikumpulkan dan dikeringkan.
Reaksinya melibatkan penambahan magnesium oksida ke dalam larutan asam fosfat dan memanaskan campuran untuk menyelesaikan reaksi. Proses tersebut kemudian mengumpulkan dan mencuci Mg3(PO4)2 yang dihasilkan untuk menghilangkan kotoran.
Reaksinya melibatkan penambahan magnesium hidroksida ke dalam larutan asam fosfat dan memanaskan campuran hingga selesai. Kemudian kumpulkan Mg3(PO4)2 yang dihasilkan dan cuci hingga bersih untuk menghilangkan semua kotoran.
Tergantung pada kualitas bahan mentah dan kondisi reaksi, metode ini dapat digunakan untuk menghasilkan Mg3(PO4)2 dengan berbagai tingkat kemurnian.
Kegunaan Magnesium Fosfat
Mg3(PO4)2 memiliki beberapa kegunaan dalam berbagai industri, antara lain:
- Industri Makanan: Digunakan sebagai bahan tambahan makanan untuk mengatur tingkat keasaman dan meningkatkan tekstur dan kualitas makanan yang dipanggang, produk susu dan minuman.
- Pertanian: Digunakan sebagai pupuk untuk menyediakan nutrisi penting bagi tanaman seperti magnesium dan fosfor.
- Industri Farmasi: Digunakan sebagai bahan aktif antasida dan obat pencahar untuk membantu meringankan gejala gangguan pencernaan dan sembelit.
- Pengolahan Air: Digunakan sebagai bahan kimia pengolahan air untuk mengendalikan pembentukan kerak pada boiler dan pipa serta untuk mencegah korosi.
- Industri keramik: Digunakan sebagai pengikat keramik untuk meningkatkan kekuatan dan daya tahan produk keramik.
- Tahan Api: Digunakan sebagai penghambat api pada bahan bangunan seperti insulasi, dinding kering, dan pelapis dinding.
- Kosmetik: Digunakan dalam kosmetik dan produk perawatan pribadi sebagai pengental dan pengemulsi.
Pertanyaan:
Q: Bagaimana rumus senyawa yang benar yang terbentuk antara ion Mg+2 dan PO43-?
A: Rumus senyawa yang benar yang terbentuk antara ion Mg+2 dan ion PO43- adalah Mg3(PO4)2.
T: Apa rumus magnesium fosfat?
A: Rumus magnesium fosfat adalah Mg3(PO4)2.
Q: Berapa banyak ion yang menyusun satu unit formula magnesium fosfat?
A: Satu unit rumus Mg3(PO4)2 mengandung 11 ion: tiga ion Mg+2 dan dua ion PO43-.
T: Apakah magnesium fosfat larut?
A: Mg3(PO4)2 memiliki kelarutan yang rendah dalam air, dengan kelarutan sekitar 0,1 g/100 mL pada suhu kamar.
Q: Asam (x) bereaksi dengan basa (y) menghasilkan Mg3(PO4)2. Apa itu x dan y?
A: Asam (x) adalah asam fosfat (H3PO4) dan basa (y) adalah magnesium hidroksida (Mg(OH)2).
Q: Berapa massa molar Mg3(PO4)2, suatu zat yang dulunya digunakan sebagai obat sebagai antasida?
A: Massa molar Mg3(PO4)2 adalah 262,86 g/mol.
Q: Apakah Mg3(PO4)2 larut dalam air?
A: Mg3(PO4)2 memiliki kelarutan yang rendah dalam air, dengan kelarutan sekitar 0,1 g/100 mL pada suhu kamar.
Q: Berapa mol atom oksigen dalam satu mol Mg3(PO4)2?
A: Satu mol Mg3(PO4)2 mengandung 8 mol atom oksigen.
