Litium karbonat (Li2CO3) adalah senyawa penting yang digunakan dalam obat penstabil suasana hati. Ini mengobati gangguan bipolar dan membantu mengelola depresi secara efektif, sehingga meningkatkan kesejahteraan mental secara keseluruhan.
| Nama IUPAC | Litium karbonat |
| Formula molekul | Li2CO3 |
| nomor CAS | 554-13-2 |
| Sinonim | Dilitium karbonat; Asam karbonat, garam dilitium; Litium karbonat(1+); Asam karbonat, garam litium (1:1) |
| Di ChI | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
Sifat litium karbonat
Rumus Litium Karbonat
Rumus dilitium karbonat adalah Li2CO3. Artinya setiap molekul mengandung dua atom litium (Li), satu atom karbon (C), dan tiga atom oksigen (O). Komposisi kimia ini memainkan peran penting dalam sifat dan penerapannya.
Massa Molar Litium Karbonat
Massa molar dilitium karbonat kira-kira 73,89 g/mol. Ini dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya, dengan mempertimbangkan proporsi masing-masing dalam rumus. Nilai ini penting untuk berbagai perhitungan kimia dan reaksi yang melibatkan dilitium karbonat.
Titik didih litium karbonat
Dilithium karbonat memiliki titik didih yang tinggi, biasanya sekitar 1.310 derajat Celsius (2.390 derajat Fahrenheit). Pada suhu ini, senyawa tersebut berubah dari cair menjadi gas, sehingga cocok untuk proses dan aplikasi industri tertentu.
Titik lebur litium karbonat
Dilithium karbonat memiliki titik leleh yang relatif rendah, biasanya sekitar 720 derajat Celcius (1.328 derajat Fahrenheit). Pada suhu ini, senyawa berubah dari padat menjadi cair, sehingga memudahkan penggunaannya dalam pembuatan keramik, kaca, dan bahan lainnya.
Massa jenis litium karbonat g/mL
Massa jenis dilitium karbonat kira-kira 2,11 g/mL. Nilai ini mewakili massa per satuan volume, yang menunjukkan seberapa rapat partikel-partikel tersebut. Kepadatan dilithium karbonat sangat penting untuk memahami sifat fisik dan perilakunya.
Berat Molekul Litium Karbonat
Dilitium karbonat memiliki berat molekul sekitar 73,89 g/mol. Nilai ini sesuai dengan massa satu mol senyawa dan penting dalam berbagai perhitungan kimia, seperti menentukan jumlah mol dalam jumlah zat tertentu.
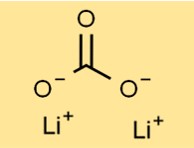
Struktur litium karbonat
Dilithium karbonat memiliki struktur kristal membentuk bubuk putih tidak berbau. Susunannya terdiri dari kation Li+ dan anion karbonat (CO3^2-) yang disatukan oleh ikatan ionik. Susunan spesifik ini berkontribusi terhadap stabilitas dan reaktivitas senyawa.
Kelarutan litium karbonat
Dilithium karbonat memiliki kelarutan yang terbatas dalam air. Ini larut sampai batas tertentu, membentuk larutan yang sedikit basa. Kelarutan dilithium karbonat merupakan pertimbangan penting dalam formulasi farmasi dan aplikasi lain yang memerlukan disolusi terkontrol.
| Penampilan | Bubuk berwarna putih dan tidak berbau |
| Berat jenis | 2,11 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 73,89 g/mol |
| Kepadatan | 2,11 gram/ml |
| Titik fusi | 720°C (1328°F) |
| Titik didih | 1310°C (2390°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Kelarutan terbatas |
| Kelarutan | Larut dalam air, membentuk larutan sedikit basa |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Sedikit basa |
Keamanan dan bahaya litium karbonat
Dilithium karbonat menimbulkan potensi bahaya keselamatan yang memerlukan penanganan hati-hati. Kontak langsung dengan kulit dapat menyebabkan iritasi, sedangkan jika tertelan dapat menyebabkan ketidaknyamanan gastrointestinal. Jika terpapar secara berlebihan, dapat memicu efek berbahaya pada sistem saraf. Tindakan pencegahan keselamatan yang tepat, seperti memakai peralatan pelindung, harus diikuti saat menanganinya untuk menghindari potensi bahaya. Sangat penting untuk menyimpan dan mengangkut dilithium karbonat jauh dari zat yang tidak kompatibel dan sumber panas atau api. Dalam situasi darurat, segera dapatkan bantuan medis. Lembar data dan pedoman keselamatan harus ditinjau dan diikuti dengan cermat saat bekerja dengan dilithium karbonat.
| Simbol bahaya | Korosif, Iritasi |
| Deskripsi Keamanan | Dapat menyebabkan iritasi. Hindari menelan. Gunakan dengan ventilasi yang memadai. Kenakan peralatan pelindung. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2836.40.00 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tidak diklasifikasikan |
| Toksisitas | Toksisitas rendah |
Metode sintesis litium karbonat
Ada metode berbeda untuk mensintesis dilitium karbonat.
Pendekatan yang umum adalah dengan memasukkan senyawa litium, seperti litium hidroksida atau litium oksida, ke karbon dioksida dalam kondisi terkendali. Reaksi tersebut menghasilkan litium karbonat dan air sebagai produk sampingan. Metode lain melibatkan pencampuran garam litium yang larut, seperti litium klorida, dengan senyawa karbonat yang larut. Reaksi tersebut membentuk endapan padat litium karbonat, yang dapat dipisahkan dan dikumpulkan oleh para peneliti.
Selain itu, dilitium karbonat dapat dihasilkan melalui dekomposisi termal litium bikarbonat. Ketika litium bikarbonat dipanaskan, ia terurai menjadi litium karbonat, melepaskan karbon dioksida dan air. Beberapa lingkungan industri menggunakan proses ini untuk memperoleh litium karbonat dengan kemurnian tinggi.
Untuk mencapai hasil dan tingkat kemurnian yang diinginkan, apapun metode yang digunakan, mereka harus memastikan kontrol yang tepat terhadap parameter reaksi, seperti suhu, tekanan dan stoikiometri. Sintesis dilithium karbonat memainkan peran penting dalam produksi senyawa ini untuk berbagai aplikasi, termasuk farmasi, keramik, dan baterai.
Kegunaan litium karbonat
Dilithium karbonat menemukan berbagai aplikasi karena sifatnya yang unik. Berikut kegunaan utamanya:
- Obat-obatan: Ini adalah komponen penting dari obat penstabil suasana hati, yang secara efektif mengobati gangguan bipolar dan depresi serta meningkatkan kesejahteraan mental.
- Baterai: Dalam baterai litium-ion yang dapat diisi ulang, dilitium karbonat berfungsi sebagai prekursor senyawa litium dan memainkan peran penting dalam teknologi penyimpanan energi.
- Kembang api: Reaksi eksotermik dilithium karbonat dengan bahan kimia tertentu membuatnya berharga dalam kembang api dan suar.
- Sintesis kimia: Sebagai sumber ion litium, penting dalam berbagai reaksi kimia dan sintesis organik.
- Sumber Logam Alkali: Bertindak sebagai sumber litium di laboratorium dan penelitian, digunakan untuk mempelajari sifat-sifat logam alkali.
- Aplikasi Lingkungan: Dilithium karbonat membantu mengatur pH dalam proses pengolahan air, mengendalikan keasaman dan alkalinitas.
- Keramik dan kaca: Dilithium karbonat meningkatkan stabilitas produk keramik dan kaca dengan berfungsi sebagai bahan fluks, sehingga mengurangi suhu leleh.
- Metalurgi: Dalam metalurgi, dilithium karbonat memurnikan logam seperti aluminium dan tembaga, secara efektif menghilangkan kotoran dan meningkatkan sifat mekaniknya.
- AC: Pengering dalam sistem AC menggunakan dilithium karbonat untuk menyerap kelembapan secara efektif, memastikan kinerja AC yang optimal.
Secara keseluruhan, beragam aplikasi dilithium karbonat menyoroti pentingnya dilithium karbonat di berbagai industri, menjadikannya senyawa berharga dalam teknologi modern, kedokteran, dan ilmu material.
Pertanyaan:
Q: Unsur manakah yang mempunyai elektron valensi paling sedikit?
J: Berilium memiliki elektron valensi paling sedikit, yaitu hanya dua.
T: Untuk apa litium karbonat digunakan?
J: Dilithium karbonat digunakan dalam obat penstabil suasana hati untuk mengobati gangguan bipolar dan depresi.
T: Apakah dilitium karbonat dapat larut?
J: Ya, dilithium karbonat sedikit larut dalam air.
T: Bagaimana cara kerja litium karbonat?
J: Dilithium karbonat bekerja dengan menstabilkan suasana hati dan menyeimbangkan neurotransmiter di otak.
T: Apa yang diperlakukan dengan litium karbonat?
J: Dilithium karbonat digunakan untuk mengobati gangguan bipolar dan depresi dalam pengobatan psikiatri.
Q: Apakah LiNO3 bersifat ionik atau kovalen?
J: LiNO3 bersifat ionik.
Q: Manakah dari berikut ini yang tidak larut dalam air? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
A: PbCl2 dan Ba(OH)2 tidak larut dalam air.
Q: Apakah Li2CO3 larut dalam air?
A: Li2CO3 sedikit larut dalam air.
Q: Berapa banyak ion yang ada di Li2CO3?
A: Li2CO3 mengandung tiga ion: dua ion Li+ dan satu ion CO3^2-.
Q: Berapa banyak satuan rumus yang terdapat dalam 0,0067 g Li2CO3?
J: Terdapat sekitar 1,24 x 10^20 unit rumus dalam 0,0067 g Li2CO3.
Q: Berapa banyak ion litium yang terdapat dalam 30,0 ml larutan Li2CO3 0,600 M?
A: Terdapat 0,036 mol ion Li+ dalam 30,0 ml larutan Li2CO3 0,600 M.
T: Berapa persen komposisi karbon dalam litium karbonat, Li2CO3?
J: Komposisi persen massa karbon dalam Li2CO3 kira-kira 11,3%.
Q: Manakah dari pasangan larutan berikut yang akan membentuk endapan jika NH4NO3 + Li2CO3 dicampur?
A: NH4NO3 + Li2CO3 tidak akan membentuk endapan karena kedua senyawa tersebut larut dalam air.
