Litium bikarbonat (LiHCO3) adalah senyawa kimia yang digunakan dalam berbagai aplikasi. Ia memiliki sifat basa dan digunakan dalam penelitian, obat-obatan, dan sebagai pengobatan potensial untuk kondisi medis tertentu.
| Nama IUPAC | Litium bikarbonat |
| Formula molekul | LiHCO3 |
| nomor CAS | 5006-97-3 |
| Sinonim | Litium hidrogen karbonat, Li bikarbonat |
| Di ChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Sifat litium bikarbonat
Rumus Litium Bikarbonat
Litium hidrogen karbonat memiliki rumus kimia LiHCO3. Terdiri dari kation litium (Li), anion hidrogen karbonat (HCO3) dan atom hidrogen (H). Rumusnya mencerminkan keberadaan ion litium dan bikarbonat dalam senyawa.
Massa Molar Litium Bikarbonat
Massa molar litium hidrogen karbonat (LiHCO3) kira-kira 68 gram per mol (g/mol). Itu dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya: litium, hidrogen, karbon, dan oksigen.
Titik didih litium bikarbonat
Litium hidrogen karbonat tidak memiliki titik didih yang jelas karena terurai pada suhu tinggi. Saat memanas, ia kehilangan karbon dioksida (CO2) dan air (H2O), berubah menjadi litium karbonat (Li2CO3).
Titik lebur litium bikarbonat
Litium hidrogen karbonat memiliki titik leleh sekitar 250 derajat Celcius (482 derajat Fahrenheit). Pada suhu ini, ia mengalami transisi fase dari padat ke cair.
Massa jenis litium bikarbonat g/mL
Massa jenis litium hidrogen karbonat (LiHCO3) kira-kira 2,21 gram per mililiter (g/mL). Ini adalah senyawa yang relatif padat karena adanya litium dan unsur berat lainnya.
Berat Molekul Litium Bikarbonat
Litium hidrogen karbonat memiliki berat molekul sekitar 68 g/mol. Berat molekul mewakili jumlah berat atom semua atom dalam satu molekul senyawa.
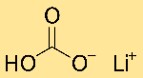
Struktur litium bikarbonat
Litium hidrogen karbonat memiliki struktur kristal. Ia membentuk jaringan atom litium, hidrogen karbonat, dan hidrogen, tersusun dalam pola berulang. Strukturnya disatukan oleh ikatan ionik dan kovalen.
Kelarutan litium bikarbonat
Litium hidrogen karbonat sulit larut dalam air. Ini larut sampai batas tertentu dalam air, menghasilkan larutan yang sedikit basa. Namun kelarutannya relatif rendah dibandingkan senyawa litium lainnya.
| Penampilan | Bubuk kristal putih |
| Berat jenis | ~2,21 gram/mL |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | ~68 g/mol |
| Kepadatan | ~2,21 gram/mL |
| Titik fusi | ~250°C (482°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedikit larut, menghasilkan larutan yang sedikit basa |
| Kelarutan | Membatasi |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Sedikit basa |
Keamanan dan bahaya litium bikarbonat
Litium hidrogen karbonat memiliki pertimbangan keamanan dan bahaya tertentu. Penting untuk menangani senyawa tersebut dengan hati-hati untuk meminimalkan risiko. Kontak langsung dengan kulit atau mata dapat menyebabkan iritasi. Menghirup debu atau asap harus dihindari, karena dapat menyebabkan ketidaknyamanan pernafasan. Saat dipanaskan, ia terurai, melepaskan karbon dioksida dan uap air, yang berpotensi berbahaya di ruang tertutup. Selain itu, penting untuk menyimpan litium hidrogen karbonat dengan benar, jauh dari zat yang tidak kompatibel. Ventilasi yang memadai dan peralatan pelindung diri harus digunakan saat bekerja dengan senyawa ini untuk memastikan lingkungan yang aman.
| Simbol bahaya | Tidak tersedia |
| Deskripsi Keamanan | Tangani dengan hati-hati. Hindari terhirup, kontak dengan kulit dan mata. Simpan dengan benar. Gunakan di area berventilasi baik. |
| Nomor identifikasi PBB | Tidak tersedia |
| kode HS | Tidak tersedia |
| Kelas bahaya | Tidak tersedia |
| Kelompok pengepakan | Tidak tersedia |
| Toksisitas | Toksisitas rendah; tangani dengan deposit. |
Metode sintesis litium bikarbonat
Berbagai metode memungkinkan sintesis litium hidrogen karbonat.
Pendekatan yang umum adalah mereaksikan litium hidroksida (LiOH) dengan karbon dioksida (CO2). Reaksi berlangsung dalam larutan air di mana litium hidroksida berdisosiasi menjadi ion litium dan hidroksida. Pada saat yang sama, karbon dioksida larut dalam air, membentuk asam karbonat (H2CO3) . Ion litium kemudian bereaksi dengan asam karbonat menghasilkan litium hidrogen karbonat (LiHCO3) dan air (H2O). Persamaan kimia untuk reaksi ini adalah:
LiOH + CO2 → LiHCO3 + H2O
Metode lain melibatkan pengolahan litium karbonat (Li2CO3) dengan karbon dioksida dalam sistem tertutup, menghasilkan litium bikarbonat. Persamaan kimia untuk reaksi ini adalah:
Li2CO3 + CO2 → 2LiHCO3
Metode sintesis ini penting untuk produksi litium hidrogen karbonat di laboratorium dan untuk aplikasi industri. Sangat penting untuk mengikuti protokol keselamatan dan memastikan peralatan dan kondisi yang tepat selama proses sintesis.
Kegunaan litium bikarbonat
Litium hidrogen karbonat banyak digunakan karena sifatnya yang unik. Berikut beberapa kegunaan utamanya:
- Penelitian dan Laboratorium: Ini berfungsi sebagai reagen yang berharga dalam berbagai eksperimen kimia dan penelitian, memungkinkan para ilmuwan mempelajari reaksi dan sifat kimia.
- Potensi Perawatan Medis: Penelitian sedang dilakukan untuk mengetahui peran potensialnya sebagai pengobatan penyakit seperti kekurangan litium dan gangguan ginjal tertentu, serta sebagai agen alkali.
- Penerapan lingkungan: Dapat berkontribusi pada penghapusan karbon dioksida dari proses industri dan memiliki potensi penerapan dalam mitigasi emisi gas rumah kaca.
- Agen Pengalkali: Dalam proses industri tertentu, ia bertindak sebagai agen alkali untuk mengontrol keasaman dan mengatur tingkat pH.
- Industri farmasi: Formulasi farmasi menggunakan litium hidrogen karbonat terutama dalam pengobatan gangguan mood seperti gangguan bipolar.
- Produksi baterai litium: Para peneliti dan kalangan eksperimental sedang menjajaki penggunaan litium hidrogen karbonat dalam baterai canggih berbasis litium untuk meningkatkan kinerja baterai.
- Pengolahan Air: Proses pengolahan air menggunakan litium bikarbonat untuk mengatur pH sumber air.
- Pertanian: Litium hidrogen karbonat jarang digunakan dalam praktik pertanian, dimana petani menggunakannya untuk mengolah kondisi tanah tertentu dan meningkatkan pertumbuhan tanaman.
Terlepas dari penerapan ini, penting untuk menangani litium hidrogen karbonat dengan hati-hati dan mengikuti tindakan pencegahan keselamatan, mengingat potensi bahaya dan reaktivitasnya. Seiring dengan berlanjutnya penelitian dan kemajuan teknologi, penggunaan baru litium hidrogen karbonat mungkin akan muncul, sehingga semakin meningkatkan pentingnya litium hidrogen karbonat dalam berbagai bidang.
Pertanyaan:
T: Apa rumus kimia litium bikarbonat?
A: Rumus kimia litium hidrogen karbonat adalah LiHCO3.
T: Dapatkah litium bikarbonat menyebabkan rendahnya vitamin D?
J: Tidak ada bukti yang menunjukkan bahwa litium hidrogen karbonat menyebabkan rendahnya kadar vitamin D.
T: Mana yang lebih baik: litium karbonat atau litium bikarbonat?
J: Efektivitas litium karbonat atau litium bikarbonat bergantung pada aplikasi spesifik dan tujuan penggunaan.
T: Apakah litium bikarbonat berinteraksi dengan ekstrak valerian?
J: Tidak ada interaksi yang diketahui antara litium hidrogen karbonat dan ekstrak valerian, namun konsultasi dengan ahli kesehatan sangatlah penting.
T: Apa itu litium bikarbonat?
J: Litium hidrogen karbonat adalah senyawa kimia dengan sifat basa, digunakan dalam berbagai aplikasi termasuk penelitian dan farmasi.
T: Dapatkah litium bikarbonat dan litium karbonat dipanaskan dalam air?
J: Litium hidrogen karbonat dan litium karbonat dapat dipanaskan dalam air, tetapi keduanya akan terurai membentuk senyawa lain.
T: Berapakah penurunan berat bila 3,45 g LiHCO3 dipecah?
A: Penurunan berat badan ketika 3,45 g LiHCO3 terurai akan bergantung pada reaksi spesifik dan produk yang terbentuk.
T: Apakah LiHCO3 merupakan elektrolit kuat?
J: Tidak, litium hidrogen karbonat (LiHCO3) adalah elektrolit lemah.
Q: Garam apa yang dihasilkan dari reaksi H2SO4 dengan LiHCO3?
A: Reaksi antara H2SO4 dan LiHCO3 akan menghasilkan litium sulfat (Li2SO4), karbon dioksida (CO2) dan air (H2O).
Q: Apakah LiHCO3 termasuk asam atau basa?
A: Litium hidrogen karbonat (LiHCO3) bertindak sebagai basa karena sifat basanya.
T: Apakah N-methylethanamine bereaksi dengan LiHCO3?
J: Reaktivitas N-methylethanamine dengan LiHCO3 akan bergantung pada kondisi reaksi spesifik dan produk yang diinginkan.
