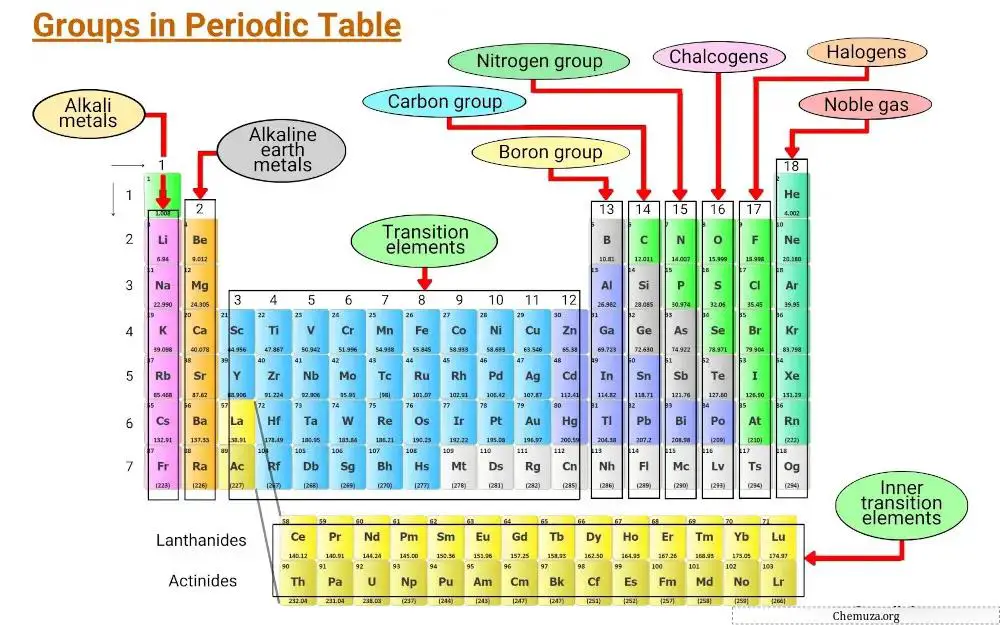
Unsur-unsur dikelompokkan berdasarkan ciri-ciri umum, termasuk konfigurasi elektronik dan perilaku elektron valensi.
Kolom vertikal tabel periodik disebut golongan, dan terdapat 18 golongan dalam tabel periodik, masing-masing memiliki sifat tersendiri yang menentukan bagaimana suatu unsur akan berinteraksi dengan unsur lain dan membentuk senyawa.
Pada artikel ini, kita akan menjelajahi berbagai golongan pada tabel periodik.
Yuk langsung saja!.
Kelompok 1: Logam alkali
Golongan 1 tabel periodik dikenal sebagai logam alkali .
Golongan ini meliputi litium, natrium, kalium, rubidium, cesium, dan fransium.
Logam alkali dikenal karena kelembutannya, titik lelehnya yang rendah, dan reaktivitasnya yang tinggi dengan air dan udara.
Logam alkali sangat reaktif karena hanya mempunyai satu elektron pada kulit terluarnya, sehingga mudah dilepaskan untuk membentuk ion positif. [1]
Hal ini menjadikannya konduktor listrik yang sangat baik dan berguna dalam banyak aplikasi, termasuk baterai dan proses industri.
Namun, karena reaktivitasnya yang tinggi, logam alkali harus ditangani dengan hati-hati. Mereka dapat terbakar secara spontan di udara dan bereaksi secara eksplosif dengan air, melepaskan gas hidrogen. [2]
Golongan 2: Logam alkali tanah
Golongan 2 pada tabel periodik dikenal sebagai “ logam alkali tanah ”. Kelompok ini mencakup enam unsur: berilium, magnesium, kalsium, strontium, barium, dan radium.
Logam-logam ini disebut “basa” karena bereaksi dengan air membentuk larutan basa (basa) .
Logam alkali tanah memiliki sifat serupa, antara lain titik leleh dan titik didih yang tinggi, massa jenis yang rendah, dan kemampuan mudah membentuk ion dengan muatan +2.
Mereka juga sangat reaktif, terutama terhadap air dan oksigen. Namun, tidak seperti logam alkali Golongan 1, logam ini kurang reaktif dan memiliki titik leleh lebih tinggi.
Unsur-unsur ini banyak ditemukan pada benda sehari-hari, antara lain tulang (kalsium), kembang api (strontium), dan bagian pesawat (magnesium).
Logam alkali tanah juga digunakan dalam proses industri, seperti produksi aluminium dan baja.
Golongan 3 – 11: Logam transisi
Golongan 3 sampai 11 pada tabel periodik dikenal sebagai golongan logam transisi . Logam-logam ini memiliki karakteristik unik yang membedakannya dari benda lain di atas meja.
Salah satu ciri khas logam transisi adalah kemampuannya membentuk senyawa berwarna.
Hal ini disebabkan konfigurasi elektroniknya yang unik, yang memungkinkannya menyerap dan memantulkan panjang gelombang cahaya tertentu. [3]
Logam transisi juga dikenal karena titik leleh dan titik didihnya yang tinggi, serta kekuatan dan daya tahannya.
Mereka sering digunakan dalam bahan bangunan, kabel listrik dan bahkan perhiasan.
Kelompok 13: kelompok boron
Golongan 13 tabel periodik dikenal sebagai golongan boron dan mencakup unsur-unsur boron (B), aluminium (Al), galium (Ga), indium (In), talium (Tl), dan nihonium (Nh).
Unsur-unsur ini memiliki karakteristik tertentu yang membuatnya serupa secara kimia.
Boron adalah satu-satunya metaloid dalam kelompok ini, yang berarti ia memiliki sifat logam dan nonlogam .
Golongan 14: Golongan karbon
Golongan 14 pada tabel periodik dikenal sebagai golongan Karbon dan meliputi Karbon (C), Silikon (Si), Germanium (Ge), Timah (Sn), Timbal (Pb) dan Flerovium (Fl).
Unsur-unsur ini mempunyai sifat serupa karena semuanya mempunyai empat elektron valensi.
Karbon merupakan unsur yang sangat penting karena merupakan dasar dari semua molekul organik, termasuk bahan penyusun kehidupan seperti protein dan DNA. [4]
Kelompok 15: Pniktogen
Golongan 15 pada tabel periodik juga dikenal sebagai golongan nitrogen (atau pniktogen).
Golongan ini mengandung 6 unsur: nitrogen (N), fosfor (P), arsenik (As), antimon (Sb), bismut (Bi) dan moscovium (Mc).
Unsur-unsur golongan 15 memiliki lima elektron valensi pada kulit elektron terluarnya, yang berarti unsur-unsur tersebut cenderung membentuk tiga ikatan kovalen untuk melengkapi oktetnya.
Mereka juga cenderung memperoleh tiga elektron untuk membentuk anion . Unsur-unsur menjadi lebih sedikit non-logam dan lebih banyak logam dalam satu golongan.
Kelompok 16: Kalkogen
Golongan 16 pada tabel periodik dikenal sebagai golongan oksigen. Ini mencakup unsur oksigen (O), belerang (S), selenium (Se), telurium (Te), polonium (Po) dan hati (Lv).
Unsur-unsur ini memiliki karakteristik tertentu, termasuk memiliki enam elektron valensi pada tingkat energi terluarnya.
Oksigen adalah unsur paling melimpah dalam kelompok ini dan penting bagi kehidupan, karena merupakan komponen kunci air dan banyak molekul organik.
Unsur-unsur dalam golongan oksigen dapat membentuk senyawa dengan banyak unsur lain, termasuk logam dan nonlogam .
Golongan 17: Halogen
Golongan 17 pada tabel periodik juga dikenal sebagai golongan halogen . Ini terdiri dari enam elemen: fluor, klor, brom, yodium, astatin dan tennessine.
Semua halogen memiliki tujuh elektron di kulit terluarnya, juga dikenal sebagai kulit valensi. Hal ini membuat mereka sangat reaktif, karena mereka hanya membutuhkan satu elektron tambahan untuk melengkapi kulit terluarnya dan menjadi stabil.
Karakteristik penting lainnya dari halogen adalah bahwa semuanya bukan logam, artinya tidak dapat menghantarkan listrik dan tidak mudah dibentuk atau ulet seperti logam.
Mereka juga ada di ketiga wujud materi pada suhu kamar, dengan fluor dan klor berbentuk gas, brom berbentuk cair, dan yodium dan astatin berbentuk padat.
Kelompok 18: Gas langka
Golongan 18 tabel periodik juga dikenal sebagai gas mulia .
Gas mulia antara lain helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn).
Gas-gas ini disebut mulia karena sangat stabil dan tidak mudah bereaksi dengan unsur lain.
Gas mulia terletak di kolom paling kanan tabel periodik dan semuanya memiliki kulit elektron terluar yang penuh, sehingga sangat tidak reaktif.
Mereka juga tidak berbau, tidak berwarna dan memiliki titik didih dan titik leleh yang rendah.
