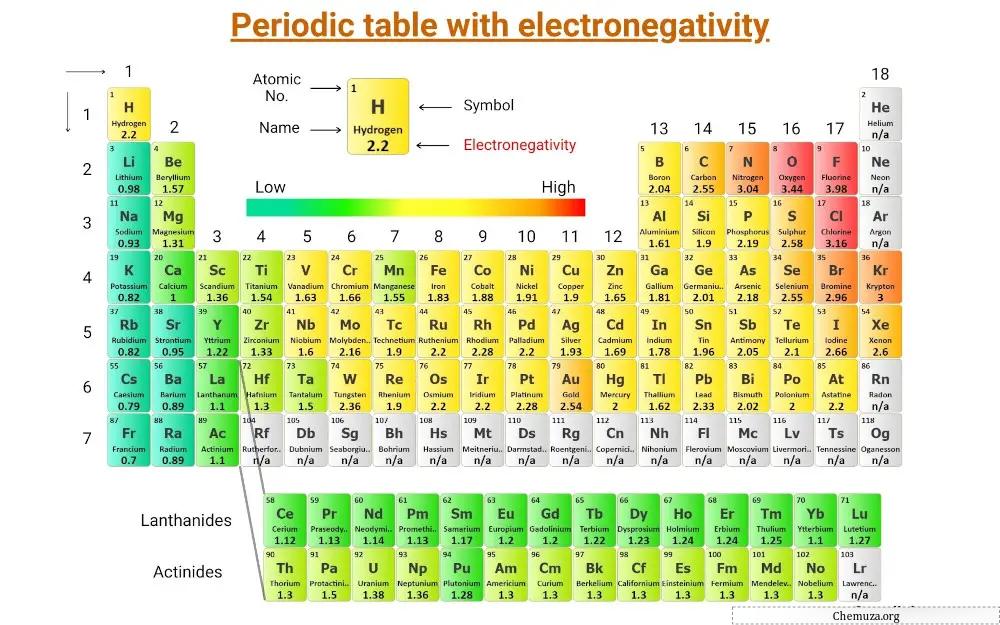
Ini adalah tabel periodik yang mencatat keelektronegatifan unsur-unsur.
(Catatan: Keelektronegatifan tidak memiliki satuan. Linus Pauling adalah seorang ilmuwan yang merancang skala keelektronegatifan yang mengurutkan unsur-unsur relatif satu sama lain. Dan skala ini dikenal sebagai skala keelektronegatifan keelektronegatifan Pauling.) [1]
Jika Anda belum mengetahui apa itu keelektronegatifan, berikut penjelasan singkatnya.
Apa itu keelektronegatifan?
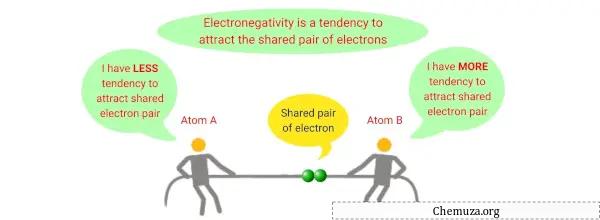
Keelektronegatifan adalah sifat kimia yang menggambarkan kemampuan suatu atom untuk menarik elektron ke dirinya sendiri ketika ia merupakan bagian dari suatu senyawa atau molekul.
Ini adalah ukuran daya tarik relatif yang diberikan atom pada elektron bersama dalam ikatan kovalen .
Mengapa keelektronegatifan penting?
Keelektronegatifan memainkan peran penting dalam memprediksi sifat ikatan kimia, reaktivitas, dan sifat fisik molekul .
Hal ini membantu menjelaskan mengapa unsur-unsur tertentu cenderung membentuk jenis ikatan tertentu, seperti ikatan kovalen atau ionik, dan bagaimana ikatan ini mempengaruhi perilaku senyawa yang dihasilkan.
Keelektronegatifan juga membantu memprediksi polaritas suatu molekul dan interaksinya dengan molekul lain, yang penting dalam banyak bidang, termasuk kimia, biologi, dan ilmu material.
Apa yang dimaksud dengan keelektronegatifan lebih tinggi?
Ketika suatu atom memiliki keelektronegatifan yang lebih tinggi, itu berarti ia memiliki kemampuan yang lebih besar untuk menarik elektron ke dirinya sendiri ketika ia merupakan bagian dari senyawa atau molekul kimia.
Hal ini mengarah pada pembentukan ikatan kovalen polar, di mana elektron tidak terbagi rata antar atom.
Atom dengan keelektronegatifan lebih tinggi menarik elektron lebih dekat ke dirinya sendiri, menghasilkan muatan parsial negatif, sedangkan atom lain dalam ikatan mempunyai muatan parsial positif.
Polaritas ini mempengaruhi sifat fisik dan kimia senyawa, seperti titik didih dan titik leleh, kelarutan, dan reaktivitas.
Contoh unsur dengan elektronegativitas tinggi antara lain fluor, oksigen, dan nitrogen.
