Kalsium oksida, juga dikenal sebagai kapur tohor, adalah zat basa berwarna putih dengan titik leleh tinggi. Ia bereaksi kuat dengan air untuk menghasilkan kalsium hidroksida dan menghasilkan panas yang signifikan. Ini digunakan dalam berbagai aplikasi industri termasuk manufaktur semen, pertanian dan pengolahan air.
| Nama IUPAC | Kalsium oksida |
| Formula molekul | CaO |
| nomor CAS | 1305-78-8 |
| Sinonim | Kapur mentah; jeruk nipis terbakar; Jeruk nipis; Abu; jeruk nipis yang tidak diperas; Kalsium (II) oksida; Kalsia; kerikil kapur; Batuan kapur; Kalsium monoksida; jeruk nipis |
| Di ChI | InChI=1S/Ca.O |
Sifat kalsium oksida
Formula Kalsium Oksida
Rumus kimia kalsium oksida adalah CaO, yang menunjukkan bahwa ia mengandung kation kalsium (Ca2+) dan anion oksida (O2-). Rumus kalsium oksida mencerminkan sifat ioniknya, di mana kation kalsium dan anion oksida terikat bersama oleh gaya elektrostatis yang kuat. Rumus kalsium oksida digunakan untuk mengidentifikasi senyawa dalam berbagai reaksi kimia dan menghitung berat molekul serta sifat fisik lainnya.
Massa Molar Kalsium Oksida
Massa molar kalsium oksida, juga dikenal sebagai kapur tohor, adalah 56.077 gram per mol. Ini diperoleh dari berat atom kalsium (40,078 g/mol) dan oksigen (15,999 g/mol) yang menyusun senyawa tersebut. Massa molar kalsium oksida digunakan dalam berbagai perhitungan, seperti menentukan jumlah reaktan yang diperlukan untuk menghasilkan sejumlah produk tertentu atau menghitung konsentrasi larutan.
Titik didih kalsium oksida
Kalsium oksida tidak memiliki titik didih karena mengalami dekomposisi termal pada suhu tinggi, bukan mendidih. Pada suhu di atas 2572°C, kalsium oksida terdisosiasi menjadi kalsium dan oksigen. Namun, dekomposisi termal kalsium oksida dapat digunakan untuk menghasilkan kalsium oksida dengan kemurnian dan reaktivitas lebih tinggi untuk aplikasi industri.
Titik Leleh Kalsium Oksida
Titik leleh kalsium oksida adalah 2572°C, menjadikannya zat dengan titik leleh tinggi. Ia memiliki titik leleh yang tinggi karena sifat ioniknya, di mana kation kalsium dan anion oksida terikat bersama oleh gaya elektrostatis yang kuat. Titik leleh kalsium oksida yang tinggi juga membuatnya berguna dalam aplikasi suhu tinggi seperti manufaktur baja dan semen.
Kepadatan kalsium oksida g/ml
Kepadatan kalsium oksida bervariasi tergantung pada struktur kristal dan kemurniannya. Kepadatan tipikal kalsium oksida adalah 3,35 g/mL untuk material curah, sedangkan kepadatan teoritis adalah 3,50 g/mL. Kepadatan kalsium oksida yang rendah disebabkan oleh strukturnya yang berpori, yang memungkinkannya menyerap kelembapan dari udara dan meningkatkan berat serta volumenya.
Berat Molekul Kalsium Oksida
Berat molekul kalsium oksida, disebut juga berat rumus atau massa molar, adalah 56,077 gram per mol. Ini dihitung dengan menambahkan berat atom kalsium dan oksigen yang menyusun senyawa. Berat molekul kalsium oksida digunakan dalam berbagai perhitungan, seperti menentukan jumlah reaktan yang diperlukan untuk menghasilkan sejumlah produk tertentu atau menghitung konsentrasi suatu larutan.
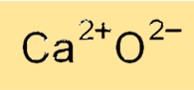
Struktur kalsium oksida
Kalsium oksida mempunyai struktur kristal kubik, dimana kation kalsium dan anion oksida tersusun dalam kisi kubik berpusat muka. Struktur kristal kalsium oksida mirip dengan natrium klorida dan senyawa ionik lainnya. Sifat ionik kalsium oksida menjadikannya isolator listrik yang baik dan bahan penting dalam pembuatan komponen elektronik.
| Penampilan | Padat berwarna putih, tidak berbau |
| Berat jenis | 3,35 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 56,077 g/mol |
| Kepadatan | 3,35 gram/cm³ |
| Titik fusi | 2572°C |
| Titik didih | Tidak mendidih, mengalami dekomposisi termal |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan air membentuk kalsium hidroksida |
| Kelarutan | Tidak larut dalam air, larut dalam asam |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | 12-13 |
Keamanan dan Bahaya Kalsium Oksida
Kalsium oksida, juga dikenal sebagai kapur tohor, adalah zat yang sangat reaktif dan bersifat kaustik yang menimbulkan beberapa bahaya bagi kesehatan manusia dan lingkungan. Jika tidak ditangani dengan benar, bahan ini dapat menyebabkan iritasi parah dan luka bakar pada kulit, mata, dan sistem pernapasan. Menghirup debu atau uap kapur dapat menyebabkan gangguan pernafasan, batuk dan sesak nafas. Ia juga sangat reaktif dengan air dan dapat melepaskan panas dalam jumlah besar, mengakibatkan luka bakar dan ledakan uap. kapur tohor harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel. Peralatan pelindung dan prosedur penanganan yang tepat harus diikuti untuk menghindari kecelakaan dan paparan.
| Simbol bahaya | Korosif (C) |
| Deskripsi Keamanan | Kenakan sarung tangan, pakaian dan pelindung mata/wajah. Tangani dan simpan dengan hati-hati. Hindari terhirup, tertelan dan kontak dengan kulit dan mata. |
| Nomor identifikasi PBB | PBB1910 |
| kode HS | 2522.20.00 |
| Kelas bahaya | 8 – Zat korosif |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis kalsium oksida
Dekomposisi termal batu kapur, reaksi kalsium hidroksida dengan panas dan elektrolisis kalsium klorida menghasilkan kalsium oksida atau kapur tohor.
Metode yang paling umum untuk mensintesis kapur tohor adalah dengan memanaskan kapur hingga suhu tinggi sekitar 900 hingga 1000°C dalam tanur kapur. Proses ini, yang dikenal sebagai kalsinasi, melepaskan karbon dioksida dan meninggalkan kapur. Pengolahan dan penggilingan kapur tohor menghasilkan bubuk halus untuk berbagai aplikasi.
Metode lain untuk mensintesis kapur tohor melibatkan pemanasan kalsium hidroksida, juga dikenal sebagai kapur sirih, hingga suhu tinggi. Proses ini, yang dikenal sebagai dehidroksilasi, juga melepaskan air dan meninggalkan kapur.
Elektrolisis kalsium klorida adalah metode yang kurang umum untuk mensintesis kapur tohor. Larutkan kalsium klorida dalam air dan alirkan arus listrik melalui larutan untuk menghasilkan gas kapur dan klorin .
Kegunaan Kalsium Oksida
Kalsium oksida yang disebut juga kapur tohor memiliki banyak kegunaan di berbagai industri karena sifatnya yang unik. Beberapa kegunaan utamanya adalah:
- Produksi Baja: Digunakan sebagai fluks dalam produksi baja, yang membantu menghilangkan kotoran dan meningkatkan kualitas baja.
- Pengolahan Air: Digunakan dalam pengolahan air untuk menghilangkan kotoran dan mengatur pH air.
- Pertanian: Digunakan dalam pertanian sebagai bahan pembenah tanah untuk mengatur pH tanah dan menyediakan nutrisi penting bagi tanaman.
- Industri kimia: digunakan dalam produksi bahan kimia seperti kalsium karbida, kalsium hipoklorit dan kalsium stearat.
- Konstruksi: Digunakan dalam industri konstruksi sebagai komponen semen, mortar dan plester.
- Industri makanan: Digunakan dalam industri makanan sebagai bahan pengencang dan pengatur keasaman.
- Industri Kertas: Digunakan dalam industri kertas sebagai komponen cairan putih yang digunakan dalam proses pembuatan pulp kraft.
- Industri Perminyakan: Digunakan dalam industri perminyakan sebagai katalis dalam proses pemurnian.
Pertanyaan:
Q: Apa rumus kalsium oksida?
A: Rumus kalsium oksida adalah CaO.
Q: Berapakah bilangan oksidasi kalsium?
A: Bilangan oksidasi kalsium dalam kalsium oksida adalah +2.
T: Apakah kalsium oksida bersifat ionik atau kovalen?
A: Kalsium oksida adalah senyawa ionik yang terdiri dari ion kalsium bermuatan positif dan ion oksida bermuatan negatif.
T: Apakah kalsium oksida berbentuk padat?
J: Ya, kalsium oksida berbentuk padat pada suhu dan tekanan ruangan standar. Ia mempunyai penampilan putih atau putih keabu-abuan dan sangat reaktif.
