Kalsium silikat (Ca2SiO4) merupakan senyawa mineral yang digunakan dalam bahan bangunan, isolasi dan tahan api. Itu dibuat dengan menggabungkan kalsium oksida dan silika. Kalsium silikat memberikan isolasi termal dan tahan api.
| Nama IUPAC | Kalsium silikat |
| Formula molekul | Ca2SiO4 |
| nomor CAS | 1344-95-2 |
| Sinonim | Asam silikat, garam kalsium (2:1); Kalsium metasilikat; Kalsium dan silikon oksida; Kalsium ortosilikat |
| Di ChI | InChI=1S/Ca.2O.Si/q+2;2*-1; |
Sifat kalsium silikat
Massa Molar Kalsium Silikat
Ca2SiO4 memiliki massa molar 172,237 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom kalsium, silikon, dan oksigen, yaitu masing-masing sebesar 40,078 g/mol, 28,085 g/mol, dan 15,999 g/mol. Massa molar penting dalam menentukan jumlah Ca2SiO4 yang dibutuhkan untuk reaksi kimia atau pembuatan larutan.
Titik didih kalsium silikat
Ca2SiO4 tidak mempunyai titik didih yang pasti karena terurai sebelum mencapai titik didihnya. Ketika Ca2SiO4 dipanaskan, ia mengalami serangkaian reaksi kimia yang menyebabkan pelepasan air dan pembentukan kalsium oksida dan silika. Suhu penguraian Ca2SiO4 bergantung pada jenis dan komposisi spesifik senyawa.
Titik Leleh Kalsium Silikat
Ca2SiO4 memiliki titik leleh 2130°C. Pada suhu ini Ca2SiO4 berubah wujud dari padat menjadi cair. Titik leleh Ca2SiO4 yang relatif tinggi sehingga cocok untuk aplikasi suhu tinggi seperti bahan tahan api, isolasi dan tahan api.
Massa jenis kalsium silikat g/mL
Kepadatan Ca2SiO4 bervariasi tergantung pada jenis dan komposisi spesifik senyawa. Kepadatan Ca2SiO4 berkisar antara 2,2 hingga 2,8 g/mL. Kepadatan Ca2SiO4 yang tinggi membuatnya berguna untuk aplikasi yang mengutamakan bobot. Misalnya digunakan sebagai agregat ringan pada beton.
Berat Molekul Kalsium Silikat
Berat molekul Ca2SiO4 adalah 172,237 g/mol. Nilai ini ditentukan dengan menambahkan berat atom kalsium, silikon dan oksigen ke dalam senyawa. Berat molekul Ca2SiO4 digunakan dalam berbagai perhitungan, seperti menentukan konsentrasi larutan atau jumlah senyawa yang dibutuhkan untuk reaksi kimia.
Struktur kalsium silikat
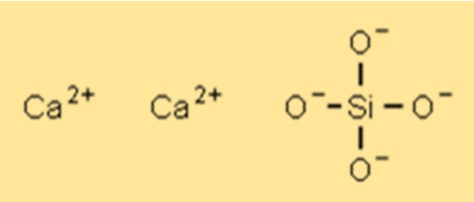
Ca2SiO4 memiliki struktur kristal yang dapat bervariasi tergantung pada jenis dan komposisi spesifik senyawanya. Struktur kristal yang paling umum adalah sistem kristal monoklinik. Struktur kristal Ca2SiO4 memberikan sifat tertentu seperti kekuatan tinggi, stabilitas termal dan ketahanan kimia.
Formula Kalsium Silikat
Rumus kimia kalsium silikat adalah Ca2SiO4. Rumus ini mewakili rasio kalsium, silikon, dan oksigen dalam senyawa. Formula kalsium silikat penting dalam menentukan sifat-sifatnya dan penggunaannya dalam berbagai aplikasi seperti semen, isolasi dan tahan api.
| Penampilan | bubuk putih |
| Berat jenis | 2,2 – 2,8 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 172,237 g/mol |
| Kepadatan | 2,2 – 2,8 gram/cm³ |
| Titik fusi | 2130°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Tidak larut dalam air, larut dalam asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | 7.0 – 9.0 |
Keamanan dan bahaya kalsium silikat
Ca2SiO4 umumnya dianggap aman untuk digunakan dalam berbagai aplikasi, termasuk bahan bangunan, insulasi, dan bahan tambahan makanan. Namun, menghirup debu Ca2SiO4 dalam waktu lama atau berlebihan dapat mengiritasi sistem pernapasan. Kontak kulit dan mata dengan Ca2SiO4 juga dapat menyebabkan iritasi. Meskipun Ca2SiO4 tidak dianggap sebagai zat berbahaya, penting untuk menanganinya dengan hati-hati dan mengikuti tindakan pencegahan keselamatan saat menangani bahan ini. Peralatan pelindung diri seperti sarung tangan, kacamata keselamatan dan pelindung pernafasan harus dipakai saat menangani Ca2SiO4 untuk meminimalkan potensi risiko kesehatan.
| Simbol bahaya | Tak dapat diterapkan |
| Deskripsi Keamanan | Bukan zat berbahaya |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 6810.19 |
| Kelas bahaya | Tak dapat diterapkan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah; dapat menyebabkan iritasi pernafasan dan kulit jika terpapar dalam waktu lama atau berlebihan |
Metode sintesis kalsium silikat
Berbagai metode dapat mensintesis Ca2SiO4.
Dalam salah satu metode, kalsium oksida (CaO) bereaksi dengan silika (SiO2) menghasilkan campuran kalsium silikat. Tungku suhu tinggi memungkinkan sintesis Ca2SiO4. Campuran tersebut meliputi Ca2SiO4 dan Ca3SiO5. Pemrosesan lebih lanjut dan penggilingan campuran menghasilkan kadar bubuk Ca2SiO4 yang berbeda.
Metode lain melibatkan reaksi antara kalsium hidroksida (Ca(OH)2) dan silika dalam autoklaf pada tekanan dan suhu tinggi. Proses ini menghasilkan bentuk murni Ca2SiO4, yang dikenal sebagai wollastonite (CaSiO3), yang memiliki beragam aplikasi, termasuk sebagai pengisi plastik dan pelapis.
Metode lain untuk mensintesis Ca2SiO4 meliputi reaksi antara kalsium klorida (CaCl2) dan natrium silikat (Na2SiO3) untuk menghasilkan Ca2SiO4 hidrat (CSH), yang merupakan pengikat utama dalam semen Portland.
Berbagai reagen dan metode memungkinkan sintesis Ca2SiO4 dengan mengendapkannya dari larutan ion kalsium dan silikat.
Kegunaan Kalsium Silikat
Ca2SiO4 memiliki beragam aplikasi karena sifatnya yang unik, seperti ketahanan suhu tinggi, konduktivitas termal rendah, dan ketahanan api yang sangat baik. Berikut beberapa kegunaan umum Ca2SiO4:
- Isolasi: Digunakan sebagai bahan isolasi dalam aplikasi suhu tinggi seperti lapisan tungku, isolasi boiler, dan saluran uap. Konduktivitas termalnya yang rendah menjadikannya isolator yang efektif di lingkungan ini.
- Bahan Bangunan: Digunakan dalam berbagai bahan bangunan seperti batu bata, ubin dan semen. Ketahanannya terhadap suhu tinggi dan api menjadikannya bahan yang ideal untuk digunakan pada dinding dan langit-langit tahan api.
- Bahan tambahan makanan: Digunakan sebagai bahan anti penggumpalan pada produk makanan seperti gula halus dan garam. Kemampuannya menyerap kelembapan dan mencegah penggumpalan menjadikannya pilihan populer di kalangan produsen makanan.
- Farmasi: Digunakan sebagai eksipien dalam produk farmasi, yang berfungsi sebagai pengikat, penghancur, dan zat aliran.
- Kosmetik: Digunakan dalam kosmetik sebagai bahan pembengkakan dan penyerap. Ini membantu meningkatkan tekstur dan rasa produk seperti bedak wajah dan alas bedak.
- Kegunaan lain: Juga digunakan dalam produksi keramik, bahan tahan api dan sebagai pengisi karet dan plastik.
Pertanyaan:
T: Bagaimana cara menghilangkan kalsium silikat dari kolam renang?
J: Untuk menghilangkan Ca2SiO4 dari kolam, gunakan pembersih ubin kolam atau larutan asam muriatik dan air. Oleskan pembersih atau larutan ke area yang terkena dan gosok dengan sikat berbulu kaku. Bilas dengan banyak air setelah dibersihkan.
T: Bagaimana cara membuat kalsium silikat tahan api di rumah?
J: Tidak disarankan membuat Ca2SiO4 tahan api di rumah karena suhu tinggi dan memerlukan peralatan khusus. Yang terbaik adalah membeli produk tahan api Ca2SiO4 yang sudah jadi dari pemasok yang memiliki reputasi baik.
Q: Senyawa kalsium silikat terhidrasi membentuk dua senyawa yang manakah?
A: Senyawa Ca2SiO4 terhidrasi membentuk Ca2SiO4 (CSH) terhidrasi dan kalsium hidroksida (Ca(OH)2). Senyawa ini berperan penting dalam pembentukan dan kekuatan beton dan material semen lainnya.
