Kalsium perklorat (Ca(ClO4)2) merupakan senyawa kimia yang memiliki banyak kegunaan, antara lain untuk kembang api dan bahan bakar roket. Ini sangat larut dalam air dan juga dapat digunakan sebagai bahan pengering.
| Nama IUPAC | Kalsium perklorat |
| Formula molekul | Ca(ClO4)2 |
| nomor CAS | 13477-36-6 |
| Sinonim | Calciofos, garam kalsium dari asam perklorat, kalsium diperklorat, kalsium (II) perklorat, UN1459 |
| Di ChI | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/jam;2 (H,2,3,4,5)/q+2;;/p-2 |
Sifat kalsium perklorat
Rumus kalsium perklorat
Rumus kalsium perklorat adalah Ca(ClO4)2. Ini terdiri dari satu ion Ca2+ dan dua ion ClO4-. Ion kalsium mempunyai muatan positif 2+ dan setiap ion ClO4- mempunyai muatan negatif 1-. Rumus ini digunakan untuk mewakili struktur kimia kalsium perklorat.
Massa Molar Kalsium Perklorat
Massa molar Ca(ClO4)2 adalah 238,98 g/mol. Nilai ini mewakili massa satu mol Ca(ClO4)2, yang mengandung bilangan Avogadro molekul. Massa molar penting dalam menentukan jumlah Ca(ClO4)2 yang dibutuhkan dalam suatu reaksi tertentu.
Titik didih kalsium perklorat
Ca(ClO4)2 tidak memiliki titik didih karena terurai sebelum mencapai titik didihnya. Ketika dipanaskan, ia terurai menjadi kalsium klorida, gas oksigen, dan gas klor. Reaksi penguraian ini sangat eksotermik, sehingga melepaskan sejumlah besar panas.
Kalsium perklorat Titik lebur
Titik leleh Ca(ClO4)2 adalah 200°C. Suhu ini adalah titik di mana Ca(ClO4)2 padat berubah menjadi cair. Titik leleh penting dalam menentukan sifat fisik Ca(ClO4)2, seperti kemampuannya digunakan sebagai bahan pengering.
Kepadatan kalsium perklorat g/mL
Massa jenis Ca(ClO4)2 adalah 2,505 g/mL. Nilai ini mewakili jumlah massa per satuan volume Ca(ClO4)2. Massa jenis Ca(ClO4)2 lebih besar dibandingkan massa jenis air, yang berarti ia tenggelam dalam air.
Berat Molekul Kalsium Perklorat
Berat molekul Ca(ClO4)2 adalah 238,98 g/mol. Nilai ini mewakili jumlah berat atom seluruh atom dalam molekul Ca(ClO4)2. Berat molekul penting dalam menentukan jumlah Ca(ClO4)2 yang dibutuhkan dalam suatu reaksi tertentu.
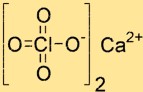
Struktur kalsium perklorat
Struktur Ca(ClO4)2 terdiri dari satu ion Ca2+ dan dua ion ClO4-. Ion Ca2+ terletak di tengah struktur dan dikelilingi oleh empat atom oksigen yang berasal dari dua ion ClO4-. Ion ClO4- berbentuk tetrahedral dan dihubungkan dengan ion kalsium oleh atom oksigen.
Kelarutan kalsium perklorat
Ca(ClO4)2 sangat larut dalam air, dengan kelarutan 121 g/100 mL pada 20°C. Kelarutan ini menjadikannya berguna sebagai bahan pengering karena dapat menyerap air dari lingkungannya. Namun, ia tidak larut dalam pelarut organik seperti etanol dan aseton.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,505 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 238,98 g/mol |
| Kepadatan | 2,505 gram/ml |
| Titik fusi | 200°C |
| Titik didih | Terurai sebelum titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 121 g/100 mL pada 20°C |
| Kelarutan | Tidak larut dalam pelarut organik |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya kalsium perklorat
Ca(ClO4)2 menimbulkan beberapa risiko keselamatan dan tindakan keselamatan yang tepat harus diambil saat menanganinya. Ini adalah oksidan kuat yang dapat bereaksi dengan bahan mudah terbakar, menyebabkan kebakaran atau ledakan. Menghirup debu atau uapnya dapat menyebabkan iritasi saluran pernafasan dan kontak dengan kulit dapat menyebabkan iritasi atau luka bakar. Hal ini juga berbahaya jika tertelan, menyebabkan iritasi atau korosi pada saluran pencernaan. Alat pelindung diri yang memadai, seperti sarung tangan dan kaca mata, harus dipakai saat menangani Ca(ClO4)2 dan harus disimpan jauh dari bahan yang mudah terbakar dan zat yang tidak kompatibel.
| Simbol bahaya | Zat pengoksidasi, berbahaya jika tertelan |
| Deskripsi Keamanan | Jauhkan dari bahan yang mudah terbakar dan zat yang tidak kompatibel. Kenakan sarung tangan dan kacamata pelindung. Hindari menghirup debu atau asap. Jika terjadi kontak, cuci dengan banyak air dan konsultasikan dengan dokter jika perlu. |
| Nomor identifikasi PBB | UN1502 |
| kode HS | 2829.9000 |
| Kelas bahaya | 5.1 – Zat pengoksidasi |
| Kelompok pengepakan | II |
| Toksisitas | Berbahaya jika tertelan, mengiritasi kulit dan sistem pernapasan |
Metode sintesis kalsium perklorat
Ca(ClO4)2 dapat disintesis dengan mereaksikan kalsium hidroksida dengan asam perklorat atau amonium perklorat.
Salah satu metodenya melibatkan mereaksikan kalsium karbonat dengan asam perklorat dalam bejana reaksi, diikuti dengan filtrasi dan penguapan larutan untuk memperoleh produk padat.
Metode lain melibatkan reaksi kalsium oksida dengan larutan asam perklorat berair, diikuti dengan penyaringan dan pengeringan produk yang dihasilkan.
Dalam beberapa kasus, Ca(ClO4)2 dapat disintesis dengan mereaksikan kalsium klorida dengan natrium perklorat dalam bejana reaksi. Produk dapat disaring dan dikeringkan untuk memperoleh Ca(ClO4)2 setelah reaksi.
Metode populer lainnya untuk mensintesis Ca(ClO4)2 melibatkan reaksi kalsium klorida dengan amonium perklorat, yang menghasilkan Ca(ClO4)2 dan amonium klorida sebagai produk sampingan. Aplikasi kembang api lebih menyukai metode ini karena kemampuannya menghasilkan Ca(ClO4)2 dengan kemurnian tinggi.
Penting untuk dicatat bahwa ketika bekerja dengan asam perklorat, tindakan pencegahan keselamatan yang tepat harus diambil, karena merupakan zat pengoksidasi kuat yang dapat bereaksi dengan bahan organik, menyebabkan kebakaran atau ledakan.
Kegunaan Kalsium Perklorat
Ca(ClO4)2 memiliki beberapa kegunaan di berbagai industri dan aplikasi. Beberapa kegunaan Ca(ClO4)2 adalah:
- Kembang api: Biasa digunakan dalam kembang api sebagai zat pengoksidasi karena kandungan oksigen dan stabilitasnya yang tinggi.
- Pupuk: Digunakan dalam pupuk untuk menyediakan kalsium dan klorin bagi tanaman, yang merupakan nutrisi penting untuk pertumbuhannya.
- Bahan Bakar Roket: Digunakan sebagai komponen bahan bakar roket karena kandungan oksigennya yang tinggi dan stabilitasnya.
- Pemurnian minyak bumi: Digunakan dalam industri perminyakan untuk menghilangkan senyawa sulfur dari minyak mentah dan hidrokarbon lainnya.
- Inflator Kantung Udara: Digunakan dalam pembuatan inflator kantung udara karena kemampuannya terurai dengan cepat dan menghasilkan gas.
- Flare: Digunakan dalam pembuatan flare karena kandungan oksigennya yang tinggi dan stabilitasnya.
- Perawatan permukaan logam: Digunakan dalam perawatan permukaan logam untuk menghilangkan karat dan kotoran lainnya.
- Aplikasi Laboratorium: Digunakan dalam berbagai aplikasi laboratorium, seperti dalam pembuatan asam perklorat dan sebagai bahan pengering.
Pertanyaan:
Q: Apa rumus kalsium perklorat?
J: Ca(ClO4)2.
T: Apakah kalsium perklorat bersifat ionik atau kovalen?
A: Ca(ClO4)2 merupakan senyawa ionik karena tersusun dari kation kalsium (Ca2+) dan anion perklorat (ClO4-).
T: Bagaimana cara membuang kalsium perklorat?
J: Ca(ClO4)2 dapat dihilangkan dengan mencuci area yang terkena dengan air, kemudian menetralkan sisa senyawa dengan basa lemah, seperti natrium bikarbonat.
T: Apakah kalsium perklorat larut?
A: Ya, Ca(ClO4)2 larut dalam air dan pelarut polar lainnya. Kelarutannya dalam air kira-kira 120 g per 100 mL air pada suhu kamar.
T: Reaksi apa yang dihasilkan kalsium perklorat dan air?
A: Ca(ClO4)2 dan air tidak bereaksi satu sama lain dalam kondisi normal.
Q: Berapa jumlah atom klor dalam 0,650 mol Ca(ClO4)2?
A: Terdapat 5,88 x 10^23 atom klor dalam 0,650 mol Ca(ClO4)2.
Q: Berapa massa molar Ca(ClO4)2?
A: Massa molar Ca(ClO4)2 adalah 238,98 g/mol.
Q: Berapakah koefisien aktivitas H dalam larutan yang mengandung HCl 0,073 M dan Ca(ClO4)2 0,0090 M?
A: Koefisien aktivitas H dalam larutan yang mengandung HCl 0,073 M dan Ca(ClO4)2 0,0090 M bergantung pada suhu dan faktor lainnya. Itu dapat dihitung menggunakan model termodinamika dan data eksperimen.
Q: Berapa mol dalam 26,0 gram Ca(ClO4)2?
A: Terdapat 0,109 mol Ca(ClO4)2 dalam 26,0 gram senyawa.
