Kalsium klorida adalah senyawa anorganik yang sangat larut dengan rumus CaCl2. Ini biasanya digunakan sebagai bahan penghilang lapisan es, pengering dan dalam produksi garam kalsium dan bahan kimia.
| Nama IUPAC | Kalsium klorida |
| Formula molekul | CaCl2 |
| nomor CAS | 10043-52-4 |
| Sinonim | Kalsium diklorida, kalsium (II) klorida |
| E509, pengawetan garam, Dowflake, Peladow, TETRA | |
| Di ChI | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
Formula Kalsium Klorida
Rumus kimia kalsium klorida adalah CaCl2. Artinya setiap unit kalsium klorida terdiri dari satu ion kalsium (Ca2+) dan dua ion klorida (Cl-). Kalsium klorida merupakan senyawa ionik, artinya ia terikat oleh gaya tarik elektrostatik antara ion kalsium yang bermuatan positif dan ion klorida yang bermuatan negatif.
Massa molar kalsium klorida
Kalsium klorida memiliki massa molar 110,98 g/mol, yang setara dengan jumlah massa atom satu atom Ca dan dua atom Cl. Ini adalah senyawa anorganik yang sangat larut dalam air. air dan biasa digunakan sebagai bahan pengering, bahan pengering dan bahan penghilang lapisan es. Kalsium klorida juga digunakan dalam produksi garam kalsium dan bahan kimia lainnya.
Titik didih CaCl2
Titik didih CaCl2 adalah 1935°C, yang merupakan titik didih yang sangat tinggi untuk senyawa anorganik. Hal ini disebabkan kuatnya ikatan ion antara ion Ca+2 dan Cl- sehingga memerlukan banyak energi untuk memutuskannya. CaCl2 merupakan senyawa higroskopis, artinya ia menyerap kelembapan dari udara dan dapat larut dalam air membentuk larutan dengan konsentrasi tinggi.
Titik lebur CaCl2
CaCl2 memiliki titik leleh 772°C. Ia memiliki struktur kristal dan biasanya ditemukan dalam bentuk anhidrat, artinya tidak mengandung molekul air. Ketika CaCl2 dipanaskan, ia terurai menjadi kalsium oksida dan gas hidrogen klorida.
Massa jenis CaCl2 g/ml
Kepadatan CaCl2 tergantung pada konsentrasi larutan. Larutan CaCl2 1 M memiliki massa jenis sekitar 1,4 g/mL, sedangkan larutan 3 M memiliki massa jenis sekitar 1,6 g/mL. Massa jenis CaCl2 padat adalah 2,15 g/cm³.
Berat molekul CaCl2
Berat molekul CaCl2 adalah 110,98 g/mol. Ini adalah senyawa anorganik yang terdiri dari satu atom Ca dan dua atom Cl. CaCl2 adalah padatan kristal putih pada suhu kamar dan sangat larut dalam air.
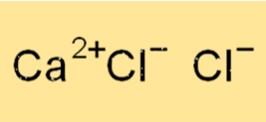
Struktur CaCl2
CaCl2 memiliki struktur kisi kristal, yang disatukan oleh ikatan ionik antara kation kalsium (Ca2+) dan anion klorida (Cl-). Setiap ion Ca+2 dikelilingi oleh enam ion Cl- dan setiap ion klorida dikelilingi oleh enam ion kalsium. Struktur kristal CaCl2 berbentuk kubik, dengan setiap sel satuan mengandung satu ion kalsium dan dua ion klorida.
| Penampilan | Padatan putih |
| Berat jenis | 2.15 (padat), 1.4-1.6 (larutan) |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 110,98 g/mol |
| Kepadatan | 2,15 g/cm³ (padat), 1,4-1,6 g/cm³ (larutan) |
| Titik fusi | 772°C |
| Titik didih | 1935°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut dalam air |
| Kelarutan | Larut dalam etanol dan aseton |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | – |
| pH | 4.5-11.0 (larutan 10%) |
Keamanan dan bahaya kalsium klorida
CaCl2 dapat menyebabkan iritasi kulit dan mata, dan menghirup debu atau kabutnya dapat menyebabkan iritasi pernafasan. Dapat juga menyebabkan luka bakar jika terkena kulit atau mata. CaCl2 bersifat higroskopis, artinya dapat menyerap kelembapan dan melepaskan panas, yang dapat menyebabkan wadah pecah atau meledak. Ia juga bersifat korosif terhadap logam tertentu dan dapat bereaksi dengan bahan organik tertentu. Peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata, harus digunakan saat menangani CaCl2. Tumpahan harus segera dibersihkan dan wadah disimpan di tempat sejuk, kering, dan berventilasi baik.
| Simbol bahaya | Korosif, Iritasi |
| Deskripsi Keamanan | Kenakan sarung tangan pelindung dan pelindung mata/wajah. Jangan menghirup debu/asap/gas/kabut/uap. |
| Nomor identifikasi PBB | UN 3077, UN 1786 (ons terhidrasi) |
| kode HS | 2827.39.90 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitasnya rendah untuk sebagian besar aplikasi, namun bisa berbahaya dalam jumlah besar |
Metode sintesis kalsium klorida
Untuk mensintesis CaCl2, tersedia beberapa metode.
Salah satu metode melibatkan mereaksikan kalsium karbonat atau kalsium hidroksida dengan asam klorida . Salah satu caranya adalah dengan menambahkan kalsium karbonat atau kalsium hidroksida ke asam klorida . Larutannya menguap menghasilkan CaCl2.
Metode lain adalah dengan mereaksikan kalsium oksida dengan asam klorida . Metode ini melibatkan penambahan kalsium oksida ke asam klorida dan kemudian menguapkan larutan untuk mendapatkan CaCl2.
Metode ketiga melibatkan mereaksikan kalsium logam dengan gas klor . Metode yang kurang umum adalah memanaskan logam kalsium dengan adanya gas klor. Reaksi tersebut menghasilkan CaCl2, namun para ahli jarang menggunakan pendekatan ini karena tingginya reaktivitas logam kalsium dan perlunya penanganan khusus.
Untuk memproduksi CaCl2 menggunakan metode yang berbeda, seseorang dapat menggunakan produk sampingan dari proses Solvay, yang menghasilkan natrium klorida dan CaCl2. Prosesnya melibatkan ekstraksi CaCl2 dari produk sampingan melalui teknik filtrasi, penguapan, dan pemurnian. Langkah-langkah ini membantu menghilangkan semua kotoran dan menghasilkan CaCl2 dengan kemurnian tinggi.
Kegunaan Kalsium Klorida
CaCl2 memiliki banyak aplikasi industri:
- Digunakan sebagai bahan pengering untuk menyerap kelembapan, bahan penghilang lapisan es untuk jalan dan trotoar, serta koagulan dalam produksi tahu dan makanan lainnya.
- Digunakan dalam industri minyak dan gas untuk meningkatkan kepadatan cairan pengeboran dan mengurangi titik beku air dalam pipa.
- Digunakan dalam campuran beton untuk mempercepat proses pengawetan dan meningkatkan kekuatan dan daya tahan produk jadi.
- Digunakan dalam produksi kertas untuk meningkatkan kekuatan dan stabilitas serat kertas.
- Digunakan dalam pengolahan air untuk menghilangkan kotoran dan melunakkan air.
- Digunakan sebagai sumber ion kalsium dalam aplikasi medis, seperti cairan infus dan untuk mengobati hipokalsemia.
- Digunakan dalam produksi plastik dan karet untuk meningkatkan kekerasan dan daya tahan produk akhir.
- Digunakan dalam pengawetan buah-buahan dan sayuran untuk mencegah pembusukan dan menjaga tekstur dan rasa produk.
- Digunakan dalam produksi tekstil untuk meningkatkan penyerapan pewarna dan meningkatkan kekuatan dan fleksibilitas serat.
- Juga digunakan dalam produksi alat pemadam kebakaran dan sebagai komponen bahan tahan api untuk mencegah penyebaran api.
Pertanyaan:
T: Apa itu kalsium klorida?
A: Kalsium klorida adalah senyawa kimia yang tersusun dari ion Ca2+ dan Cl- dengan rumus kimia CaCl2.
T: Apakah kalsium klorida bersifat ionik atau kovalen?
J: CaCl2 merupakan senyawa ionik karena tersusun dari ion Ca2+ yang bermuatan positif dan ion Cl- yang bermuatan negatif, disatukan melalui ikatan ionik.
T: Untuk apa kalsium klorida digunakan?
J: CaCl2 memiliki banyak kegunaan di industri, komersial dan medis, termasuk sebagai bahan pengering, bahan penghilang lapisan es, koagulan dalam produksi makanan, akselerator pada beton, pelembut air dan sumber ion kalsium dalam perawatan medis.
Q: Apa rumus kalsium klorida?
A: Rumus kalsium klorida adalah CaCl2, yang menunjukkan bahwa setiap molekul mengandung satu ion kalsium dan dua ion klorida.
Q: Apakah CaCl2 bersifat ionik atau kovalen?
J: CaCl2 merupakan senyawa ionik karena tersusun dari ion kalsium bermuatan positif dan ion klorida bermuatan negatif, disatukan oleh ikatan ionik.
Q: Apakah CaCl2 larut dalam air?
A: Ya, CaCl2 sangat larut dalam air, artinya mudah larut dalam air membentuk larutan bening.
Q: Jika CaCl2 dilarutkan dalam air, apa yang dapat kita katakan tentang konsentrasi ion Ca2+?
A: Ketika CaCl2 dilarutkan dalam air, ia terdisosiasi menjadi ion penyusunnya, Ca2+ dan 2Cl-. Karena CaCl2 terdisosiasi sempurna dalam air, konsentrasi ion Ca2+ dalam larutan adalah dua kali konsentrasi CaCl2.
