Kalsium klorat (Ca(ClO3)2) adalah senyawa kimia yang tersusun dari kalsium, klorin, dan oksigen. Ini biasanya digunakan sebagai zat pengoksidasi dalam kembang api dan korek api. Dapat juga digunakan untuk mensterilkan peralatan di industri makanan.
| Nama IUPAC | Kalsium klorat |
| Formula molekul | Ca(ClO3)2 |
| nomor CAS | 10137-74-3 |
| Sinonim | Asam klorida, garam kalsium; Kalsium klorat terhidrasi; Kalsium perklorat; Kalsioklorit; UN1456 |
| Di ChI | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/jam;2 (H,2,3,4)/q+2;;/p-2 |
Sifat kalsium klorat
Formula Kalsium Klorat
Rumus kalsium klorat adalah Ca(ClO3)2. Ini terdiri dari satu ion Ca2+ dan dua ion ClO3-. Kalsium klorat merupakan senyawa ionik, artinya ia terikat oleh gaya tarik elektrostatis antara ion positif dan negatif.
Massa Molar Kalsium Klorat
Massa molar Ca(ClO3)2 adalah 206,98 g/mol. Hal ini dapat dihitung dengan menambahkan massa atom kalsium, klorin dan oksigen yang menyusun senyawa tersebut. Massa molar penting untuk menghitung jumlah Ca(ClO3)2 yang dibutuhkan untuk suatu reaksi.
Titik didih kalsium klorat
Ca(ClO3)2 tidak memiliki titik didih karena terurai sebelum mencapai titik didihnya. Saat dipanaskan, Ca(ClO3)2 terurai menjadi kalsium klorida (CaCl2) dan gas oksigen (O2). Penguraian ini bersifat eksotermik dan dapat berbahaya jika tidak ditangani dengan benar.
Kalsium klorat Titik lebur
Titik leleh Ca(ClO3)2 adalah 135°C. Ini adalah suhu di mana senyawa padat berubah dari padat menjadi cair. Ca(ClO3)2 berbentuk padatan kristal putih pada suhu dan tekanan kamar.
Massa jenis kalsium klorat g/mL
Massa jenis Ca(ClO3)2 adalah 2,4 g/mL. Artinya satu mililiter Ca(ClO3)2 beratnya 2,4 gram. Massa jenis adalah ukuran kepadatan molekul dalam suatu zat. Ca(ClO3)2 lebih padat dibandingkan air yang memiliki massa jenis 1 g/mL.
Berat Molekul Kalsium Klorat
Berat molekul Ca(ClO3)2 adalah 206,98 g/mol. Ini sama dengan massa molar dan dapat dihitung dengan menjumlahkan berat atom masing-masing unsur dalam senyawa.
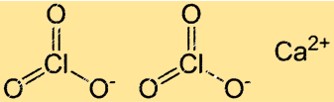
Struktur kalsium klorat
Ca(ClO3)2 memiliki struktur kisi kristal yang khas pada senyawa ionik. Dalam struktur ini, ion Ca2+ dan ClO3- tersusun dalam pola yang teratur dan berulang. Setiap ion Ca2+ dikelilingi oleh enam ion ClO3- dan setiap ion klorat dikelilingi oleh enam ion kalsium.
Kelarutan kalsium klorat
Ca(ClO3)2 larut dalam air dan membentuk larutan bening dan tidak berwarna. Kelarutan Ca(ClO3)2 dalam air meningkat seiring suhu. Namun, ia kurang larut dalam pelarut organik seperti etanol dan aseton. Ca(ClO3)2 juga bersifat higroskopis, artinya ia menyerap kelembapan dari udara. Hal ini dapat membuat senyawa menjadi basah atau larut seiring waktu.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2.4 |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 206,98 g/mol |
| Kepadatan | 2,4 gram/ml |
| Titik fusi | 135°C |
| Titik didih | Terurai sebelum titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air, kurang larut dalam pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya kalsium klorat
Ca(ClO3)2 dianggap sebagai zat berbahaya dan harus ditangani dengan hati-hati. Ini adalah zat pengoksidasi yang dapat bereaksi keras dengan bahan organik, menyebabkan kebakaran dan ledakan. Menghirup atau menelan Ca(ClO3)2 dapat menyebabkan iritasi pernafasan dan pencernaan. Kontak yang terlalu lama dapat menyebabkan iritasi kulit, luka bakar dan kemungkinan reaksi alergi. Penting untuk memakai alat pelindung diri yang sesuai saat menangani Ca(ClO3)2, termasuk sarung tangan, kacamata dan respirator. Jika terpapar, segera dapatkan bantuan medis. Simpan Ca(ClO3)2 di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Oh, Xn |
| Deskripsi Keamanan | Jauhkan dari bahan organik. Kenakan alat pelindung diri. Simpan di tempat sejuk, kering, dan berventilasi baik. |
| Nomor identifikasi PBB | UN1458 |
| kode HS | 2829.11.00 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan atau terhirup. Dapat menyebabkan iritasi kulit dan mata. Dapat menyebabkan iritasi pernafasan. |
Metode sintesis kalsium klorat
Untuk mensintesis Ca(ClO3)2, kita dapat menggunakan metode yang berbeda.
Metode yang umum melibatkan reaksi kalsium hidroksida dengan gas klor. Dalam proses ini, kalsium klorida pertama kali dibentuk sebagai produk sampingan, yang bereaksi dengan sisa klorin membentuk Ca(ClO3)2.
Metode lain melibatkan reaksi kalsium karbonat dengan asam nitrat dan gas klor. Untuk memperoleh Ca(ClO3)2, larutan yang diperoleh diuapkan dan dikristalkan.
Pendekatan lain melibatkan elektrolisis larutan yang mengandung kalsium klorida dan natrium klorat. Proses ini menghasilkan Ca(ClO3)2 dan natrium klorida sebagai produk akhir.
Reaksi antara kalsium hipoklorit dan natrium klorat menghasilkan Ca(ClO3)2, yang kemudian dimurnikan dan dikristalkan.
Kegunaan Kalsium Klorat
Ca(ClO3)2 mempunyai beberapa kegunaan penting dalam berbagai industri. Berikut adalah beberapa aplikasi Ca(ClO3)2 yang paling umum:
- Pemutih: Digunakan sebagai bahan pemutih pada industri pulp dan kertas.
- Kembang Api: Zat pengoksidasi yang biasa digunakan dalam produksi kembang api.
- Korek api: Juga digunakan dalam produksi korek api pengaman, karena mudah terbakar.
- Herbisida: Digunakan sebagai herbisida karena dapat membunuh gulma tertentu secara selektif tanpa merusak tanaman.
- Zat pengoksidasi: Digunakan sebagai zat pengoksidasi dalam produksi bahan kimia lainnya, seperti perklorat dan klorat.
- Farmasi: Juga digunakan dalam produksi produk farmasi, seperti obat anti infeksi.
- Reagen laboratorium: digunakan sebagai reagen laboratorium untuk kimia analitik.
- Produksi Pigmen: Digunakan dalam produksi pigmen, seperti biru laut.
Pertanyaan:
Q: Apa rumus kalsium klorat?
A: Rumus kimia kalsium klorat adalah Ca(ClO3)2.
T: Untuk apa kalsium klorat digunakan?
A: Ca(ClO3)2 memiliki berbagai aplikasi dalam industri, seperti bahan pemutih pada industri pulp dan kertas, bahan pengoksidasi dalam produksi bahan kimia lainnya, herbisida, pigmen produksi dan reagen laboratorium.
T: Apakah kalsium klorat berbentuk padat?
A: Ya, Ca(ClO3)2 berbentuk padat pada suhu kamar.
T: Di manakah natrium klorat paling umum ditemukan dan untuk apa kalsium klorat digunakan?
A: Natrium klorat paling banyak ditemukan dalam industri kimia, yang digunakan sebagai zat pengoksidasi dan herbisida. Ca(ClO3)2, sebaliknya, digunakan sebagai zat pemutih, zat pengoksidasi dan herbisida di berbagai industri.
Q: Berapa jumlah atom dalam senyawa Ca(ClO3)2?
A: Senyawa Ca(ClO3)2 mempunyai total 13 atom: 1 atom kalsium, 2 atom klor, dan 6 atom oksigen dari kedua ion ClO3-.
Q: Berapa persentase massa klorin dalam Ca(ClO3)2?
A: Massa atom klor adalah 35,5 g/mol dan massa molar Ca(ClO3)2 adalah 238,98 g/mol. Jadi persentase massa klorin dalam Ca(ClO3)2 adalah (2 x 35,5 g/mol) / 238,98 g/mol x 100% = 29,68%.
Q: Berapa jumlah atom klor pada Ca(ClO3)2?
A: Ada dua atom klor dalam Ca(ClO3)2, yang diwakili oleh dua gugus ClO3.
Q: Berapa massa masing-masing senyawa dalam campuran awal Ca(ClO3)2 dan Ca(ClO)2?
A: Tidak mungkin menentukan massa setiap senyawa dalam campuran asal tanpa informasi tambahan, seperti massa total atau perbandingan massa kedua senyawa.
