Kalsium karbida adalah senyawa kimia dengan rumus CaC2. Hal ini terutama digunakan untuk memproduksi gas asetilena dan kalsium sianamida. Bereaksi dengan air menghasilkan gas asetilena dan kalsium hidroksida. Orang menggunakannya untuk pengelasan dan penerangan.
| Nama IUPAC | Kalsium etynediide |
| Formula molekul | CaC2 |
| nomor CAS | 75-20-7 |
| Sinonim | Kalsium asetilida, kalsium perkarbon, kalsium dikarbida, kalsium karburo, karburo kalsiko, kalsium etynediide |
| Di ChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Sifat kalsium karbida
Formula Kalsium Karbida
Rumus kimia kalsium karbida adalah CaC2. Artinya molekul kalsium karbida terdiri dari satu atom kalsium dan dua atom karbon. Rumusnya menunjukkan perbandingan unsur-unsur senyawa.
Massa Molar Kalsium Karbida
Massa molar CaC2 adalah 64,099 g/mol. Artinya satu mol CaC2 mempunyai massa 64,099 gram. Massa molar dihitung dengan menambahkan massa atom unsur-unsur dalam rumus. Massa atom kalsium adalah 40,078 g/mol dan karbon adalah 12,011 g/mol.
Titik didih kalsium karbida
Titik didih CaC2 adalah 2300°C. Artinya CaC2 berubah wujud dari cair menjadi gas pada suhu tersebut. Titik didih dipengaruhi oleh gaya antarmolekul dan tekanan atmosfer. CaC2 memiliki ikatan ionik yang kuat sehingga membutuhkan banyak energi untuk memutuskannya.
Titik lebur kalsium karbida
Titik leleh CaC2 adalah 2160°C. Artinya CaC2 berubah wujud padat menjadi cair pada suhu tersebut. Titik leleh juga dipengaruhi oleh gaya antarmolekul dan tekanan atmosfer. CaC2 memiliki titik leleh yang tinggi karena ikatan ionnya yang kuat.
Kepadatan kalsium karbida g/ml
Massa jenis CaC2 adalah 2,22 g/ml. Artinya satu mililiter CaC2 mempunyai massa 2,22 gram. Massa jenis dihitung dengan membagi massa dengan volume. Massa jenis bergantung pada konfigurasi dan susunan atom atau molekul dalam suatu zat. CaC2 memiliki kepadatan yang tinggi karena atom-atomnya tersusun rapat dalam struktur kristal.
Berat Molekul Kalsium Karbida
Berat molekul CaC2 adalah 64.099 sma (satuan massa atom). Artinya molekul CaC2 mempunyai massa 64.099 sma. Berat molekul dihitung dengan mengalikan massa atom unsur-unsur dalam rumus dengan jumlah atomnya masing-masing. Massa atom kalsium adalah 40,078 sma dan karbon adalah 12,011 sma.
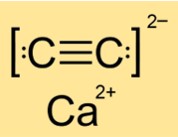
Struktur kalsium karbida
Struktur CaC2 bersifat tetragonal, monoklinik atau monoklinik tergantung fasenya (I, II atau III). Artinya CaC2 mempunyai bentuk dan susunan atom atau molekulnya yang berbeda-beda dalam keadaan atau kondisi yang berbeda-beda. Strukturnya ditentukan oleh simetri dan geometri zat. CaC2 memiliki struktur tetragonal pada fase I, struktur monoklinik pada fase II, dan struktur monoklinik lainnya pada fase III.
Kelarutan kalsium karbida
Kelarutan CaC2 adalah hidrolisis cepat dalam air. Artinya CaC2 bereaksi cepat dengan air dan membentuk gas asetilena dan kalsium hidroksida sebagai produknya. Kelarutan diukur dengan jumlah zat yang dapat larut dalam pelarut tertentu pada suhu dan tekanan tertentu. Kelarutan bergantung pada sifat dan polaritas zat dan pelarut, serta faktor lain seperti pH dan salinitas.
| Penampilan | Serbuk putih dengan kristal abu-abu/hitam atau padatan kristal tak berwarna3 |
| Kepadatan spesifik | 2.22 |
| Warna | Tidak berwarna (murni) atau abu-abu/coklat (kualitas teknis) |
| Bau | Tidak berbau (murni) atau seperti bawang putih (tingkat teknis) |
| Masa molar | 64,099 g/mol |
| Kepadatan | 2,22 gram/cm3 |
| Titik fusi | 2160°C |
| Titik didih | 2300°C |
| Titik kilat | 305°C (asetilen) |
| Kelarutan dalam air | Hidrolisis cepat |
| Kelarutan | Tidak larut dalam etanol dan eter |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | 2.21 (asetilen) |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Kalsium Karbida
CaC2 adalah bahan kimia yang mudah terbakar dan berbahaya. Ini dapat menyebabkan bahaya kebakaran dan ledakan jika terkena air atau kelembapan. Ini melepaskan gas asetilen, yang juga mudah terbakar dan meledak. CaC2 juga dapat membahayakan kesehatan Anda. Hal ini dapat mengiritasi kulit, mata, dan paru-paru. Hal ini dapat menyebabkan ruam, kerusakan mata, batuk, dan sesak napas. Hal ini juga dapat menyebabkan cairan menumpuk di paru-paru jika Anda menghirupnya dalam jumlah besar. Anda harus menghindari kontak dengan CaC2 dan memakai alat pelindung saat menanganinya. Anda juga harus menyimpannya dalam wadah yang kering dan tertutup, jauh dari sumber api.
| Simbol bahaya | F (sangat mudah terbakar), C (korosif), W (bereaksi dengan air) |
| Deskripsi Keamanan | S2 (jauhkan dari jangkauan anak-anak), S7/8 (jaga wadah tertutup rapat dan kering), S16 (jauhkan dari sumber api), S26 (jika kena mata, segera bilas dengan banyak air dan dapatkan bantuan medis saran), S36/37/39 (pakai pakaian pelindung, sarung tangan dan pelindung mata/wajah yang sesuai), S43 (jika terjadi kebakaran, gunakan pasir kering atau bubuk kimia kering), S45 (jika terjadi kecelakaan atau ketidaknyamanan, carilah saran medis segera) |
| Nomor identifikasi PBB | PBB 1402 |
| kode HS | 28491000 |
| Kelas bahaya | 4.3 |
| Kelompok pengepakan | SAYA |
| Toksisitas | Tikus LD50 oral: 80 mg/kg, tikus inhalasi LC50: 1000 ppm/4 jam |
Metode Sintesis Kalsium Karbida
Ada beberapa metode berbeda untuk mensintesis CaC2 dari sumber kalsium dan karbon oksida.
Salah satu metode yang paling umum adalah metode tungku busur listrik. Dalam proses ini, busur listrik memanaskan campuran kapur dan kokas hingga sekitar 2.200°C. Reaksinya bersifat endotermik dan menghasilkan lelehan CaC2 dan karbon monoksida. Setelah meleleh, CaC2 didinginkan dan orang menggilingnya menjadi potongan-potongan atau bubuk, tergantung tujuan penggunaannya. Metode ini memerlukan konsumsi energi dan biaya peralatan yang tinggi.
Metode lainnya adalah metode solid state. Untuk melakukan metode ini, panaskan campuran kalsium oksida dan biochar atau arang yang berasal dari biomassa dalam oven hingga suhu sekitar 1.750°C. Reaksinya padat-padat dan menghasilkan CaC2 padat dan karbon monoksida. Anda dapat langsung menggunakan atau mengolah lebih lanjut padatan CaC2 tersebut. Metode ini memiliki konsumsi energi dan biaya peralatan yang lebih rendah dibandingkan metode tungku busur listrik.
Metode ketiga adalah metode substitusi kualitas tenaga kokas batubara. Untuk melakukan prosesnya, batubara kualitas rendah dan kapur dicampur, dibentuk pelet, kemudian dipirolisis dalam oven bersuhu 1000°C. Gas yang dihasilkan menghasilkan listrik, dan pelet panas dipindahkan ke oven CaC2 pada suhu 2000°C. Reaksinya padat-padat dan menghasilkan lelehan CaC2 dan karbon monoksida. Setelah dingin, lelehan CaC2 mengalami penggilingan hingga membentuk gumpalan atau bubuk. Metode ini memiliki efisiensi energi dan pemanfaatan sumber daya yang lebih tinggi dibandingkan metode tungku busur listrik.
Kegunaan Kalsium Karbida
- Ketika CaC2 bereaksi dengan air menghasilkan gas asetilen dan kalsium hidroksida. Gas asetilena merupakan perantara penting untuk sintesis banyak bahan kimia organik dan polimer, seperti polivinil klorida, vinil asetat, 1,4-butanediol, dll. Kalsium hidroksida adalah senyawa serbaguna dengan banyak kegunaan.
- Untuk menghasilkan kalsium sianamida, manusia mereaksikan CaC2 dengan nitrogen pada suhu tinggi. Kalsium sianamida bertindak sebagai pupuk nitrogen, herbisida, dan defoliant.
- Untuk mengurangi kandungan sulfur pada besi, besi tuang, besi tuang dan baja digunakan CaC2. Senyawa kimia ini bereaksi dengan belerang membentuk kalsium sulfida, yang secara efektif mendesulfurisasi logam. Proses ini meningkatkan kualitas dan keuletan produk baja.
- Lampu karbida menggunakan CaC2 untuk menghasilkan gas asetilen yang bila dibakar akan menghasilkan cahaya. Lampu ini populer di industri pertambangan, penjelajahan gua, bersepeda, dan otomotif sebelum lampu listrik menjadi umum.
- Orang menggunakan CaC2 sebagai bahan pemasak pada buah-buahan seperti pisang, mangga, dan pepaya. Ini melepaskan gas etilen, yang mempercepat proses pematangan dan meningkatkan warna dan rasa manis buah. Banyak negara menganggap praktik penggunaan residu CaC2 untuk mematangkan buah-buahan ilegal dan berbahaya karena risiko kesehatan yang terkait dengannya.
- Orang-orang menggunakan CaC2 pada meriam bambu dan meriam big bang untuk mengeluarkan suara keras. Ketika dicampur dengan air akan menghasilkan gas asetilena yang menyala sehingga menciptakan pengalaman yang menyenangkan dan meriah bagi semua orang.
- Juga digunakan sebagai deoxidizer dalam pembuatan baja. Ini menghilangkan oksigen dari baja cair dan mencegah pembentukan oksida yang dapat mempengaruhi kualitas produk baja.
Pertanyaan:
T: Dimana bisa membeli kalsium karbida secara lokal?
J: Anda mungkin dapat menemukan CaC2 dalam jumlah kecil di daerah Anda di beberapa toko perangkat keras atau peralatan las. Namun, jika Anda membutuhkan CaC2 dalam jumlah besar, sebaiknya impor langsung dari produsen. Anda dapat menghubungi beberapa pemasok secara online.
T: Bagaimana cara menghilangkan kalsium karbida?
J: CaC2 merupakan limbah berbahaya dan harus dibuang dengan benar. Anda tidak boleh membuangnya ke tempat sampah atau ke saluran pembuangan, karena dapat bereaksi dengan air dan menghasilkan gas asetilen, yang mudah terbakar dan meledak. Anda harus menghubungi otoritas limbah berbahaya setempat atau perusahaan pembuangan limbah berlisensi untuk mendapatkan saran tentang cara membuang CaC2 dengan aman. Mungkin perlu dinetralkan dengan air di tempat yang berventilasi baik dan kemudian dikemas dalam wadah tertutup untuk diangkut.
T: Apa yang terbentuk ketika kalsium karbida bereaksi dengan air berat?
J: Air berat adalah air yang mengandung deuterium, bukan hidrogen. Deuterium adalah isotop hidrogen yang memiliki satu proton dan satu neutron pada intinya. Ketika CaC2 bereaksi dengan air berat, ia membentuk kalsium hidroksida dan asetilena deuterasi. Asetilena deuterasi adalah asetilena yang mengandung deuterium, bukan hidrogen. Persamaan kimia untuk reaksi ini adalah:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
T: Apakah kalsium karbida berbahaya?
J: Ya, CaC2 berbahaya dan harus ditangani dengan hati-hati. Bahan ini dapat menyebabkan bahaya kebakaran dan ledakan jika terkena air atau kelembapan, karena melepaskan gas asetilen, yang juga mudah terbakar dan meledak. Ini juga dapat membahayakan kesehatan Anda karena dapat mengiritasi kulit, mata, dan paru-paru. CaC2 dapat menyebabkan ruam kulit, kerusakan mata, batuk, dan sesak napas. Hal ini juga dapat menyebabkan cairan menumpuk di paru-paru jika Anda menghirupnya dalam jumlah besar. Anda harus menghindari kontak dengan CaC2 dan memakai alat pelindung saat menanganinya. Anda juga harus menyimpannya dalam wadah yang kering dan tertutup, jauh dari sumber api.
T: Apakah kalsium karbida bersifat ionik atau kovalen?
Jawaban: CaC2 merupakan senyawa ionik. Ini terdiri dari ion kalsium (Ca2+) dan ion karbida (C22-). Senyawa ionik terbentuk ketika atom logam kehilangan elektron dan atom bukan logam memperoleh elektron untuk mencapai konfigurasi elektronik yang stabil. Ion-ion yang dihasilkan disatukan oleh gaya tarik-menarik elektrostatis. CaC2 memiliki ikatan ionik yang kuat sehingga membutuhkan banyak energi untuk memutuskannya.
T: Bagaimana kalsium karbida dibuat?
A: CaC2 diperoleh dengan memanaskan campuran kapur (kalsium oksida) dan kokas (karbon) hingga suhu sekitar 2200°C dalam tungku busur listrik. Reaksinya bersifat endotermik dan menghasilkan lelehan CaC2 dan karbon monoksida. CaC2 cair kemudian didinginkan dan digiling menjadi potongan-potongan atau bubuk. Metode ini memerlukan konsumsi energi dan biaya peralatan yang tinggi. Ada juga metode lain yang menggunakan sumber karbon berbeda, seperti biochar atau batubara peringkat rendah, dan metode pemanasan berbeda, seperti pemanasan solid-state atau pemanasan induksi. Metode ini memiliki konsumsi energi dan biaya peralatan yang lebih rendah dibandingkan metode tungku busur listrik.
T: Bisakah saya mengubah kalsium karbonat menjadi kalsium karbida?
J: Tidak, Anda tidak bisa langsung mengubah kalsium karbonat menjadi CaC2. Kalsium karbonat merupakan senyawa stabil yang tidak bereaksi dengan karbon pada suhu tinggi. Kalsium karbonat terlebih dahulu harus diubah menjadi kalsium oksida dengan cara memanaskannya secara kuat tanpa adanya udara (kalsinasi). Kemudian Anda dapat mereaksikan kalsium oksida dengan karbon pada suhu tinggi untuk menghasilkan CaC2 (karburisasi). Persamaan kimia keseluruhan untuk proses ini adalah:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
Q: Manakah yang benar dari reaksi berikut? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
A: Pernyataan berikut ini benar untuk reaksi:
- Ini adalah reaksi sintetik di mana dua atau lebih unsur bergabung membentuk suatu senyawa.
- Ini adalah reaksi eksotermik, dimana panas dilepaskan ke lingkungan.
- Ini adalah reaksi redoks, di mana kalsium teroksidasi dan karbon tereduksi.
- Ini adalah reaksi kebalikan dari pembentukan CaC2 dari kalsium oksida dan karbon.
Q: Berapakah kalor standar pembentukan cac2(s)?
J: Panas pembentukan standar cac2(s) adalah perubahan entalpi ketika satu mol CaC2 terbentuk dari unsur-unsurnya dalam keadaan standarnya pada 25°C dan 1 atm. Hal ini dapat dihitung dari persamaan termokimia yang diberikan menggunakan hukum Hess. Persamaan keseluruhan pembentukan CaC2 adalah:
Ca(s) + 2C(s) -> CaC2(s)
Dengan menggunakan hukum Hess, kita dapat menulis:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Oleh karena itu, panas pembentukan standar cac2(s) adalah -680,10 kJ/mol.
Q: Berapa gram cac2 yang diperlukan untuk menghasilkan 0,35 mol hcch(g)?
J: Untuk menjawab pertanyaan ini, kita perlu menggunakan persamaan setara reaksi antara CaC2 dan air:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Dari persamaan ini kita dapat melihat bahwa satu mol cac2 menghasilkan satu mol hcch (disebut juga asetilena). Oleh karena itu, untuk menghasilkan 0,35 mol hcch, kita memerlukan 0,35 mol cac2. Untuk mengkonversi dari mol ke gram, kita perlu menggunakan massa molar cac2, yaitu 64,099 g/mol. Dengan mengalikan mol dengan massa molar, diperoleh:
0,35 mol x 64,099 g/mol = 22,435 g
Oleh karena itu, diperlukan 22,435 gram cac2 untuk menghasilkan 0,35 mol hcch.
Q: Berapa mol cac2 yang diperlukan untuk bereaksi sempurna dengan 49,0 g air?
J: Untuk menjawab pertanyaan ini, kita perlu menggunakan persamaan setara reaksi antara kalsium karbida dan air:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Dari persamaan ini kita dapat melihat bahwa satu mol cac2 bereaksi dengan dua mol h2o. Oleh karena itu, untuk mencari mol cac2 yang dibutuhkan, kita perlu membagi mol h2o dengan dua. Untuk mengkonversi gram ke mol, kita perlu menggunakan massa molar air, yaitu 18,015 g/mol. Dengan membagi gram dengan massa molar, diperoleh:
49,0 g / 18,015 g/mol = 2,72 mol
Membaginya dengan dua menghasilkan:
2,72 mol / 2 = 1,36 mol
Oleh karena itu, kita memerlukan 1,36 mol cac2 untuk bereaksi sempurna dengan 49,0 g h2o.
T: Apa produk reaksi antara kalsium karbida dan air?
A: Produk reaksi antara CaC2 dan air adalah gas asetilena dan larutan kalsium hidroksida.
