Kalsium hipoklorit (Ca(ClO)2) merupakan senyawa kimia yang biasa digunakan sebagai desinfektan dan pemutih. Efektif dalam membunuh bakteri, virus dan ganggang dalam pengolahan air dan sanitasi.
| Nama IUPAC | Kalsium hipoklorit |
| Formula molekul | Ca(ClO)2 |
| nomor CAS | 7778-54-3 |
| Sinonim | Garam kalsium dari asam hipoklorit, bubuk pemutih, kapur terklorinasi, Kalsium oksiklorida, HTH, Kal hipo |
| Di ChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Sifat kalsium hipoklorit
Formula Kalsium Hipoklorit
Kalsium hipoklorit memiliki rumus kimia Ca(ClO)2. Ini adalah padatan kristal putih yang mengeluarkan bau klorin yang kuat. Rumus kalsium hipoklorit menunjukkan bahwa ia mengandung satu ion Ca+2 dan dua ion ClO-. Ion hipoklorit mempunyai muatan negatif dan bertanggung jawab atas sifat oksidasi kuat senyawa tersebut.
Massa Molar Kalsium Hipoklorit
Massa molar Ca(ClO)2 adalah 142,98 g/mol. Ini dihitung dengan menambahkan massa atom kalsium, klorin dan oksigen yang ada dalam molekul Ca(ClO)2. Massa molar Ca(ClO)2 merupakan parameter penting yang digunakan dalam berbagai perhitungan kimia.
Titik didih kalsium hipoklorit
Ca(ClO)2 terurai sebelum mencapai titik didihnya. Oleh karena itu, titik didihnya tidak dapat ditentukan dengan jelas. Ketika Ca(ClO)2 dipanaskan, ia mengalami dekomposisi termal untuk membentuk kalsium klorida, oksigen, dan gas klor.
Titik lebur kalsium hipoklorit
Titik leleh Ca(ClO)2 adalah 100°C. Pada suhu ini, Ca(ClO)2 meleleh membentuk cairan bening. Ca(ClO)2 sangat larut dalam air dan bila dilarutkan dalam air akan melepaskan ion hipoklorit sehingga menjadi disinfektan yang efektif.
Massa jenis kalsium hipoklorit g/mL
Massa jenis Ca(ClO)2 adalah 2,35 g/mL. Ini adalah senyawa yang relatif padat dan lebih berat dari air. Kepadatan Ca(ClO)2 yang tinggi disebabkan oleh adanya ion kalsium dalam kisi kristalnya.
Berat Molekul Kalsium Hipoklorit
Berat molekul Ca(ClO)2 adalah 142,98 g/mol. Ini dihitung dengan menambahkan massa atom kalsium, klorin dan oksigen yang ada dalam molekul Ca(ClO)2. Berat molekul Ca(ClO)2 merupakan parameter penting yang digunakan dalam berbagai perhitungan kimia.
Struktur kalsium hipoklorit
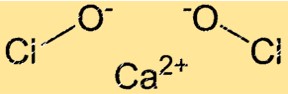
Ca(ClO)2 memiliki struktur kristal. Kisi kristal Ca(ClO)2 tersusun dari ion Ca+2 dan ion ClO-. Ion ClO- tersusun dalam geometri tetrahedral di sekitar ion Ca+2. Struktur kisi kristal Ca(ClO)2 memberinya sifat pengoksidasi yang kuat.
Kelarutan kalsium hipoklorit
Ca(ClO)2 sangat larut dalam air. Ini larut dalam air untuk membentuk ion hipoklorit dan ion kalsium. Kelarutan Ca(ClO)2 dalam air meningkat seiring dengan meningkatnya suhu. Ca(ClO)2 juga larut dalam pelarut organik seperti aseton dan etanol.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2.35 |
| Warna | Putih |
| Bau | Bau klorin |
| Masa molar | 142,98 g/mol |
| Kepadatan | 2,35 gram/cm³ |
| Titik fusi | 100°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 21g/100ml (20°C) |
| Kelarutan | Larut dalam aseton, etanol, gliserol dan air |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 7.5 |
| pH | ~11 |
Keamanan dan Bahaya Kalsium Hipoklorit
Ca(ClO)2 bisa berbahaya jika tidak ditangani dengan benar. Ini adalah oksidan kuat yang dapat bereaksi hebat dengan senyawa organik, melepaskan gas beracun. Ini dapat menyebabkan iritasi kulit dan mata, dan paparan yang terlalu lama dapat menyebabkan masalah pernapasan. Itu harus disimpan di tempat sejuk, kering dan berventilasi baik, jauh dari bahan organik, zat pereduksi dan asam. Ca(ClO)2 harus ditangani dengan hati-hati dan peralatan pelindung, seperti sarung tangan dan kacamata, harus dipakai saat menanganinya. Bahan ini tidak boleh dicampur dengan bahan kimia lain, termasuk asam atau zat pereduksi, karena dapat menyebabkan ledakan.
| Simbol bahaya | O, Xi, N |
| Deskripsi Keamanan | Berbahaya jika tertelan, menyebabkan iritasi kulit, menyebabkan iritasi mata yang serius, dapat menyebabkan kanker |
| Nomor identifikasi PBB | UN1748 |
| kode HS | 2828.90.00 |
| Kelas bahaya | 5.1 (Agen pengoksidasi) |
| Kelompok pengepakan | II |
| Toksisitas | LD50 (lisan, tikus) = 850 mg/kg; LC50 (inhalasi, tikus) = 10,8 mg/m³ (paparan 4 jam) |
Metode sintesis kalsium hipoklorit
Ada beberapa metode untuk mensintesis Ca(ClO)2.
Salah satu metodenya adalah dengan mencampurkan gas klor dengan kapur mati, yang juga dikenal sebagai kalsium hidroksida , ke dalam air. Reaksi menghasilkan Ca(ClO)2, kalsium klorida dan air. Metode lain melibatkan mereaksikan gas klor dengan kalsium hidroksida kering, menghasilkan Ca(ClO)2 dan uap air.
Proses produksi Ca(ClO)2 skala besar biasanya melibatkan reaksi natrium hipoklorit dengan kalsium klorida , yang menghasilkan Ca(ClO)2 dan natrium klorida.
Metode lain melibatkan mereaksikan kalsium karbonat dengan gas klor dengan adanya air atau asam asetat. Reaksi menghasilkan Ca(ClO)2, karbon dioksida, air atau kalsium asetat, dan asam klorida.
Metode-metode ini memerlukan penanganan yang hati-hati dan peralatan yang sesuai untuk menjamin keamanan dan efektivitas. Pilihan metode tergantung pada skala produksi dan kemurnian produk akhir yang diinginkan.
Kegunaan Kalsium Hipoklorit
Ca(ClO)2 memiliki kegunaan yang luas karena sifat pengoksidasi dan desinfektannya yang kuat. Berikut beberapa kegunaan umum Ca(ClO)2:
- Pengolahan air: banyak digunakan untuk mendisinfeksi air di kolam renang, sistem air minum dan instalasi pengolahan air limbah.
- Pemutih: Digunakan sebagai bahan pemutih untuk kapas, linen dan pulp kertas, serta dalam pembuatan kertas dan tekstil.
- Disinfeksi: Biasa digunakan untuk mendisinfeksi permukaan dan peralatan di industri makanan.
- Deodorisasi: Digunakan untuk menghilangkan bau tidak sedap dari kain, karpet dan bahan lainnya.
- Disinfektan: Disinfektan yang efektif untuk rumah sakit, laboratorium, dan fasilitas kesehatan lainnya.
- Pengendalian Alga: Digunakan untuk mengendalikan pertumbuhan alga di perairan, seperti kolam dan danau.
- Sintesis kimia: Digunakan dalam sintesis berbagai senyawa organik dan anorganik.
- Penggunaan rumah tangga: Digunakan sebagai disinfektan rumah tangga, terutama untuk membersihkan dan mendisinfeksi toilet dan pipa.
- Pengeboran Sumur Minyak: Juga digunakan dalam pengeboran sumur minyak untuk mencegah pertumbuhan bakteri dan mikroorganisme lainnya.
Pertanyaan:
T: Bisakah Anda menggunakan kalsium hipoklorit untuk menghilangkan tato?
J: Tidak, Ca(ClO)2 tidak boleh digunakan untuk menghilangkan tato. Ini adalah zat pengoksidasi kuat yang dapat menyebabkan kerusakan serius dan jaringan parut pada kulit.
T: Bagaimana cara menyimpan kalsium hipoklorit?
J: Ca(ClO)2 harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari sinar matahari langsung, sumber panas, dan zat yang tidak kompatibel. Itu harus disimpan dalam wadah tertutup rapat dan terlindung dari kelembaban dan air.
T: Dimana membeli kalsium hipoklorit?
J: Ca(ClO)2 dapat dibeli dari perusahaan pemasok bahan kimia, toko perlengkapan kolam renang, dan pengecer online.
Q: Berapa banyak kalsium hipoklorit untuk air minum?
J: Jumlah Ca(ClO)2 yang dibutuhkan untuk pengolahan air minum tergantung pada konsentrasi larutan dan volume air yang akan diolah. Dosis yang dianjurkan umumnya antara 0,2 dan 0,5 ppm (bagian per juta) untuk desinfeksi rutin.
T: Berapa banyak kalsium hipoklorit yang aman untuk dikonsumsi?
J: Ca(ClO)2 tidak boleh tertelan, karena sangat beracun dan dapat menyebabkan masalah kesehatan serius atau bahkan kematian.
Q: Pemurnian air dengan kalsium hipoklorit?
J: Ca(ClO)2 umumnya digunakan untuk pemurnian dan desinfeksi air di berbagai tempat, termasuk kolam renang, sistem air minum, dan instalasi pengolahan air limbah.
T: Kejutan kalsium hipoklorit?
J: Kejutan Ca(ClO)2 adalah proses penambahan konsentrasi Ca(ClO)2 yang lebih tinggi ke kolam atau spa untuk meningkatkan kadar klorin dengan cepat dan menghilangkan bakteri dan kontaminan berbahaya.
T: Kalsium hipoklorit untuk mendisinfeksi air?
J: Ca(ClO)2 adalah disinfektan kuat yang sering digunakan dalam pengolahan dan pemurnian air untuk menghilangkan bakteri, virus, dan mikroorganisme berbahaya lainnya.
Q: Apakah Ca(OCl)2 termasuk asam atau basa?
A: Kalsium hipoklorit (Ca(OCl)2) merupakan basa karena dapat menerima proton untuk membentuk ion hidroksida.
Q: Bentuk tereduksi Ca(OCl)2 apa yang tersisa pada akhir percobaan?
J: Bentuk tereduksi Ca(OCl)2 yang tersisa pada akhir percobaan bergantung pada reaksi spesifik yang terjadi. Dalam beberapa kasus mungkin berupa kalsium klorida (CaCl2) atau kalsium karbonat (CaCO3).
