Kalsium hidroksida (Ca(OH)2) adalah senyawa kimia yang digunakan dalam berbagai aplikasi seperti produksi makanan, pengolahan air, dan konstruksi. Itu dibuat dengan mencampurkan kalsium oksida dengan air dan memiliki penampilan putih seperti tepung.
| Nama IUPAC | Kalsium hidroksida |
| Formula molekul | Ca(OH)2 |
| nomor CAS | 1305-62-0 |
| Sinonim | Jeruk nipis, jeruk nipis, jeruk nipis, acar jeruk nipis |
| Di ChI | InChI=1S/Ca.2H2O/jam;2*1H2/q+2;;/p-2 |
Sifat kalsium hidroksida
Formula Kalsium Hidroksida
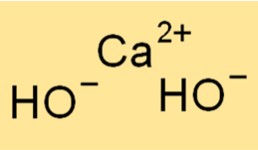
Rumus kimia kalsium hidroksida adalah Ca(OH)2. Artinya setiap molekul kalsium hidroksida mengandung satu ion Ca2+ dan dua ion OH-. Rumusnya penting dalam kimia karena mewakili jumlah dan jenis atom dalam suatu senyawa.
Massa Molar Kalsium Hidroksida
Ca(OH)2 memiliki massa molar 74,09 g/mol. Ini terdiri dari satu atom kalsium, dua atom oksigen dan dua atom hidrogen. Massa molar merupakan properti penting dalam kimia karena digunakan untuk menghitung jumlah suatu zat dalam sampel tertentu.
Titik didih kalsium hidroksida
Ca(OH)2 memiliki titik didih yang sangat tinggi yaitu 2400°C. Artinya, dibutuhkan sejumlah besar panas untuk mengubah wujudnya dari cair menjadi gas. Titik didih yang tinggi disebabkan oleh ikatan ion yang kuat antara ion kalsium dan hidroksida.
Titik Leleh Kalsium Hidroksida
Ca(OH)2 memiliki titik leleh yang relatif rendah yaitu 580°C. Artinya, dapat dengan mudah dicairkan dan dibentuk menjadi berbagai bentuk. Titik leleh yang rendah disebabkan oleh sifat ionik senyawa, yang memungkinkan ion bergerak lebih bebas saat dipanaskan.
Massa jenis kalsium hidroksida g/mL
Massa jenis Ca(OH)2 adalah 2,24 g/mL. Artinya merupakan senyawa yang relatif berat dibandingkan air yang mempunyai massa jenis 1 g/mL. Kepadatan yang tinggi disebabkan oleh sifat ion Ca2+ dan OH- yang sangat kompak.
Berat Molekul Kalsium Hidroksida
Berat molekul Ca(OH)2 adalah 74,09 g/mol. Ini adalah jumlah berat atom atom kalsium, oksigen, dan hidrogen dalam senyawa. Berat molekul merupakan properti penting dalam kimia, karena digunakan untuk menghitung berbagai parameter seperti molaritas dan persentase komposisi.
Struktur kalsium hidroksida
Ca(OH)2 memiliki struktur kristal, dengan setiap ion kalsium dikelilingi oleh enam ion hidroksida dalam susunan oktahedral. Struktur ini memberikan senyawa tersebut ciri khasnya tampak putih dan bertepung. Ikatan ionik antara ion Ca2+ dan OH- kuat, sehingga senyawa ini memiliki titik leleh dan titik didih yang tinggi.
| Penampilan | bubuk putih |
| Berat jenis | 2,24 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 74,09 g/mol |
| Kepadatan | 2,24 gram/cm³ |
| Titik fusi | 580°C |
| Titik didih | 2.400°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 1,7 gram/L (20°C) |
| Kelarutan | Larut dalam asam |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 12.5 (disosiasi pertama) |
| pH | 12,5 (larutan 0,1 M, 25°C) |
Keamanan dan Bahaya Kalsium Hidroksida
Ca(OH)2 umumnya dianggap aman jika ditangani dengan benar. Namun, bisa berbahaya jika tertelan, terhirup, atau terkena kulit atau mata. Hal ini dapat menyebabkan iritasi, luka bakar, dan masalah pernapasan. Debu dari senyawa tersebut juga dapat mengiritasi sistem pernafasan. Peralatan pelindung seperti sarung tangan, kacamata dan respirator harus dipakai saat menangani Ca(OH)2. Senyawa tersebut juga harus disimpan di tempat yang sejuk, kering, dan berventilasi baik, jauh dari bahan yang tidak kompatibel. Jika terjadi kontak atau tertelan, segera dapatkan bantuan medis.
| Simbol bahaya | Xi (Menjengkelkan) |
| Deskripsi Keamanan | Kenakan sarung tangan pelindung dan pelindung mata/wajah. |
| Nomor identifikasi PBB | tahun 1910 |
| kode HS | 2825.90.90 |
| Kelas bahaya | 8 – Zat korosif |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Kalsium hidroksida umumnya dianggap tidak beracun bila ditangani dengan benar. Namun, jika tertelan atau terhirup, dapat mengiritasi dan membakar sistem pernapasan dan saluran pencernaan. |
Metode sintesis kalsium hidroksida
Berbagai metode dapat mensintesis Ca(OH)2.
Metode umum untuk mensintesis Ca(OH)2 adalah dengan mereaksikan air dengan kalsium oksida , menghasilkan pembentukan kapur mati atau kapur terhidrasi.
Metode lain melibatkan reaksi kalsium klorida dengan natrium hidroksida. Reaksi air dan karbon dioksida dengan kalsium karbonat menghasilkan Ca(OH)2.
Proses hidrasi melibatkan pencampuran air dengan kalsium oksida menggunakan metode kapur sirih. Reaksi ini menghasilkan Ca(OH)2 dan panas sebagai produk sampingan. Proses ini selanjutnya menghilangkan kotoran dan kelebihan air dari pasta yang dihasilkan.
Metode kalsium klorida melibatkan pencampuran kalsium klorida dan natrium hidroksida dalam proses yang disebut dekomposisi ganda.
Reaksi ini menghasilkan Ca(OH)2 dan natrium klorida sebagai produk sampingan. Ca(OH)2 yang dihasilkan kemudian dimurnikan dan dikeringkan.
Dalam metode kalsium karbonat, kalsium karbonat terlebih dahulu dipanaskan untuk menghasilkan kalsium oksida dan karbon dioksida. Proses hidrasi melibatkan pencampuran kalsium oksida dengan air, yang menghasilkan Ca(OH)2.
Kegunaan Kalsium Hidroksida
Ca(OH)2 memiliki banyak kegunaan dalam berbagai industri, antara lain:
- Konstruksi: Digunakan sebagai komponen kunci dalam produksi beton, mortar dan plesteran karena kemampuannya untuk memperkuat dan meningkatkan daya tahan bahan-bahan tersebut.
- Pertanian: Digunakan sebagai bahan pembenah tanah untuk mengurangi keasaman tanah dan meningkatkan kesuburan tanah.
- Pengolahan Air: Digunakan untuk melunakkan air dengan menghilangkan kotoran seperti ion magnesium dan kalsium.
- Manufaktur kimia: digunakan dalam produksi berbagai bahan kimia seperti kalsium stearat, kalsium hipoklorit dan kalsium fosfat.
- Industri makanan: digunakan sebagai bahan tambahan makanan untuk mengatur tingkat keasaman pada produk makanan seperti acar, zaitun dan minuman ringan.
- Industri Medis: Digunakan dalam berbagai prosedur gigi, seperti perawatan saluran akar dan penambalan gigi berlubang, karena sifat antimikroba dan antijamurnya.
- Industri Pulp dan Kertas: Digunakan dalam produksi kertas untuk meningkatkan kilap dan kekuatan kertas.
- Industri kulit: Digunakan dalam pengolahan kulit untuk menghilangkan rambut dan kotoran.
Pertanyaan:
T: Apakah kalsium hidroksida larut?
A: Ca(OH)2 cukup larut dalam air, dengan kelarutan sekitar 1,2 g/L pada suhu kamar.
Q: Apa rumus kalsium hidroksida?
A: Rumus kalsium hidroksida adalah Ca(OH)2.
T: Di mana bisa membeli kalsium hidroksida di dekat saya?
J: Ca(OH)2 dapat dibeli di toko bahan kimia, toko perangkat keras, atau pengecer online. Anda dapat mencari toko bahan kimia atau toko perangkat keras di dekat daerah Anda atau memeriksa pengecer online seperti Amazon atau eBay.
Q: Apakah Ca(OH)2 termasuk asam atau basa?
Jawaban: Ca(OH)2 adalah basa. Ini adalah basa kuat yang terdisosiasi sempurna dalam air membentuk ion kalsium (Ca2+) dan ion hidroksida (OH-).
Q: Ketika terjadi reaksi H3PO4(aq)+Ca(OH)2(aq)→, apa rumus garam yang terbentuk?
A: Reaksi antara H3PO4(aq) dan Ca(OH)2(aq) masing-masing menghasilkan kalsium fosfat (Ca3(PO4)2) dan air (H2O) sebagai garam dan produk samping.
Q: Apakah Ca(OH)2 larut dalam air?
A: Ya, Ca(OH)2 cukup larut dalam air. Ia dapat larut dalam air membentuk larutan jenuh dengan konsentrasi sekitar 1,2 g/L pada suhu kamar.
Q: Apakah Ca(OH)2 merupakan basa kuat?
A: Ya, Ca(OH)2 adalah basa kuat. Ini adalah senyawa yang sangat basa yang terdisosiasi sempurna dalam air membentuk ion Ca2+ dan OH-, menjadikannya basa kuat.
Q: Manakah yang dihasilkan jika HCl bereaksi dengan Ca(OH)2?
A: Jika HCl bereaksi dengan Ca(OH)2 maka produk yang terbentuk adalah kalsium klorida (CaCl2) dan air (H2O), karena ion H+ dari HCl bereaksi dengan ion OH- dari Ca(OH)2 membentuk air, sedangkan ion Ca2+ dan Cl- yang tersisa membentuk garam, kalsium klorida.
