Kalsium fosfat (Ca3(PO4)2) adalah mineral yang ditemukan pada gigi dan tulang. Ini membantu membuat mereka kuat dan sehat. Ini juga digunakan sebagai suplemen makanan untuk mencegah kekurangan kalsium.
| Nama IUPAC | Kalsium fosfat |
| Formula molekul | Ca3(PO4)2 |
| nomor CAS | 7758-87-4 |
| Sinonim | Trikalsium fosfat, fosfat tulang, kalsium ortofosfat, kalsium fosfat tribasic, TCP |
| Di ChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/jam;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Sifat kalsium fosfat
Formula Kalsium Fosfat
Rumus kimia kalsium fosfat adalah Ca3(PO4)2 yang berarti mengandung tiga ion kalsium dan dua ion fosfat. Rumusnya digunakan untuk menghitung jumlah kalsium fosfat yang dibutuhkan untuk reaksi kimia. Kalsium fosfat merupakan komponen penting gigi dan tulang dan juga digunakan dalam berbagai aplikasi industri, seperti bahan tambahan makanan dan pupuk.
Massa Molar Kalsium Fosfat
Massa molar Ca3(PO4)2 adalah 310,18 g/mol. Dihitung dengan menjumlahkan massa atom kalsium, fosfor dan oksigen, masing-masing sebesar 40,08 g/mol, 30,97 g/mol, dan 15,99 g/mol. Massa molar merupakan parameter penting dalam menentukan jumlah Ca3(PO4)2 yang dibutuhkan dalam suatu reaksi kimia.
Titik didih kalsium fosfat
Ca3(PO4)2 tidak mempunyai titik didih pasti karena terurai sebelum mencapai titik didihnya. Saat dipanaskan, Ca3(PO4)2 terurai menjadi kalsium oksida dan fosfor pentoksida, melepaskan uap air. Suhu penguraian tergantung pada jenis Ca3(PO4)2 dan laju pemanasan.
Titik Leleh Kalsium Fosfat
Titik leleh Ca3(PO4)2 tergantung pada jenis Ca3(PO4)2. Titik leleh trikalsium fosfat, bentuk Ca3(PO4)2 yang paling melimpah di alam, adalah sekitar 1670°C. Dikalsium fosfat memiliki titik leleh sekitar 1400°C, sedangkan monokalsium fosfat meleleh pada suhu sekitar 109°C.
Kepadatan kalsium fosfat g/mL
Kepadatan Ca3(PO4)2 bervariasi tergantung pada jenis Ca3(PO4)2. Trikalsium fosfat memiliki kepadatan sekitar 3,14 g/mL, sedangkan dikalsium fosfat memiliki kepadatan sekitar 2,31 g/mL. Monokalsium fosfat memiliki kepadatan sekitar 2,22 g/mL.
Berat Molekul Kalsium Fosfat
Berat molekul Ca3(PO4)2 adalah 310,18 g/mol, yang setara dengan jumlah berat atom kalsium, fosfor, dan oksigen. Berat molekul penting untuk menghitung jumlah Ca3(PO4)2 yang dibutuhkan untuk reaksi kimia.
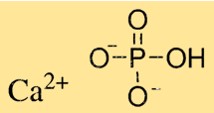
Struktur kalsium fosfat
Ca3(PO4)2 memiliki struktur kristal kompleks yang bergantung pada jenis Ca3(PO4)2. Trikalsium fosfat memiliki struktur kristal heksagonal, sedangkan dikalsium fosfat memiliki struktur kristal monoklinik. Monokalsium fosfat memiliki struktur kristal tetragonal. Kristal Ca3(PO4)2 tersusun atas ion kalsium dan ion fosfat yang tersusun dalam pola tertentu.
| Penampilan | Bubuk putih atau kristal |
| Berat jenis | 3.14 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 310,18 g/mol |
| Kepadatan | 3,14 g/mL (trikalsium fosfat) |
| Titik fusi | 1670 °C (trikalsium fosfat) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | T/A |
| Kelarutan dalam air | 0,002 g/100 ml (pada 25°C) |
| Kelarutan | Larut dalam asam, tidak larut dalam air |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH | 5.5-7.5 (suspensi 10% dalam air) |
Keamanan dan Bahaya Kalsium Fosfat
Ca3(PO4)2 umumnya dianggap aman untuk dikonsumsi manusia dan tidak menimbulkan risiko kesehatan yang signifikan. Ini adalah mineral alami yang ditemukan di tulang dan gigi dan digunakan sebagai suplemen makanan dalam berbagai bentuk. Ca3(PO4)2 juga digunakan dalam industri makanan sebagai bahan tambahan makanan dan kondisioner adonan. Namun konsumsi suplemen Ca3(PO4)2 yang berlebihan dapat menimbulkan efek samping seperti sakit perut, sembelit, bahkan kerusakan ginjal. Selain itu, paparan debu Ca3(PO4)2 dalam jumlah tinggi di tempat kerja dapat menyebabkan gangguan pernafasan. Oleh karena itu, penting untuk menggunakan suplemen dan produk Ca3(PO4)2 dalam jumlah sedang dan mengikuti pedoman keselamatan industri.
| Simbol bahaya | Tidak ada yang diketahui |
| Deskripsi Keamanan | 26-36/37/39: Kenakan pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai. |
| Nomor identifikasi PBB | T/A |
| kode HS | 28352500 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis kalsium fosfat
Ada beberapa metode untuk sintesis Ca3(PO4)2, antara lain presipitasi, sintesis hidrotermal, proses sol-gel, dan reaksi keadaan padat.
Metode pengendapan melibatkan penggabungan ion kalsium dan fosfat dalam larutan berair, menghasilkan pembentukan endapan melalui reaksi kimia. Eksperimen kemudian mencuci dan mengeringkan endapan untuk memperoleh senyawa Ca3(PO4)2 yang diinginkan.
Sintesis hidrotermal melibatkan reaksi sumber kalsium dan fosfat dalam lingkungan bertekanan tinggi dan bersuhu tinggi. Untuk memperoleh senyawa Ca3(PO4)2 yang diinginkan, produk yang dihasilkan dicuci dan dikeringkan.
Dalam proses sol-gel, sol atau suspensi koloid diubah menjadi gel dan kemudian dikeringkan untuk memperoleh senyawa Ca3(PO4)2 yang diinginkan. Metode ini memungkinkan kontrol yang tepat terhadap komposisi dan morfologi senyawa yang diperoleh.
Reaksi keadaan padat melibatkan pencampuran kalsium pirofosfat dan kalsium karbonat dalam keadaan padat dan kemudian memanaskan campuran untuk mendorong reaksi kimia. Untuk memperoleh senyawa Ca3(PO4)2 yang diinginkan, produk yang diperoleh harus dicuci dan dikeringkan.
Kegunaan Kalsium Fosfat
Ca3(PO4)2 memiliki banyak kegunaan di berbagai industri karena sifatnya yang unik. Beberapa kegunaan umum Ca3(PO4)2 adalah:
- Suplemen Makanan: Biasa digunakan dalam suplemen makanan sebagai sumber kalsium dan fosfor, yang merupakan mineral penting untuk kesehatan tulang.
- Industri Makanan dan Minuman: Digunakan sebagai bahan tambahan makanan pada banyak makanan olahan, termasuk makanan yang dipanggang, produk susu, dan minuman. Dalam pembuatan kue, orang menggunakannya sebagai bahan pembentuk dan sumber kalsium.
- Industri Farmasi: Digunakan dalam industri farmasi sebagai bahan pengisi dan pengikat pada tablet dan kapsul. Beberapa obat dapat ditingkatkan bioavailabilitasnya dengan menggunakannya sebagai bahan pelapis.
- Pertanian: Digunakan sebagai pupuk untuk menyediakan nutrisi penting bagi tanaman seperti kalsium dan fosfor.
- Kedokteran Gigi: Digunakan dalam kedokteran gigi untuk remineralisasi gigi dan memulihkan enamel gigi.
- Rekayasa Biomedis: Juga digunakan dalam rekayasa biomedis untuk mengembangkan pengganti cangkok tulang dan untuk meningkatkan sifat-sifat biomaterial yang digunakan dalam rekayasa jaringan tulang.
Pertanyaan:
Q: Mengapa penambahan asam meningkatkan kelarutan kalsium fosfat?
J: Penambahan asam meningkatkan kelarutan Ca3(PO4)2 dengan memprotonasi ion fosfat, membuatnya lebih larut dalam air. Ion fosfat terprotonasi membentuk Ca3(PO4)2 yang bersifat asam, yang lebih larut dibandingkan bentuk netral.
Q: Berapa gram fosfor dalam 500,0 gram kalsium fosfat?
A: Massa molar Ca3(PO4)2 adalah 310,18 g/mol. Senyawa tersebut mempunyai perbandingan fosfor/kalsium 2:3, sehingga massa molar fosfor adalah 30,97 g/mol. Oleh karena itu terdapat 81,62 gram fosfor dalam 500,0 gram Ca3(PO4)2.
T: Apakah kalsium fosfat larut?
A: Ca3(PO4)2 memiliki kelarutan yang rendah dalam air, dengan kelarutan produk 1,8 x 10^-29. Namun kelarutannya dapat ditingkatkan dengan penambahan asam.
T: Berapa persentase oksigen, berdasarkan massa, dalam kalsium fosfat?
A: Massa molar Ca3(PO4)2 adalah 310,18 g/mol. Massa atom oksigen adalah 16,00 g/mol dan terdapat 8 atom oksigen dalam satu mol Ca3(PO4)2. Jadi massa oksigen dalam satu mol Ca3(PO4)2 adalah 8 x 16,00 = 128,00 g. Massa Ca3(PO4)2 adalah 310,18 g, jadi persentase oksigen berdasarkan massa adalah (128,00 g / 310,18 g) x 100% = 41,23%.
Q: Apakah Ca3(PO4)2 larut dalam air?
A: Ca3(PO4)2 tidak terlalu larut dalam air, dengan kelarutan produk 1,3 x 10^-33.
Q: Berapa massa molar Ca3(PO4)2?
A: Massa molar Ca3(PO4)2 adalah 310,18 g/mol.
T: Apa itu Ca3(PO4)2?
A: Ca3(PO4)2 adalah senyawa kimia yang tersusun dari tiga ion Ca2+ dan dua ion PO43-. Ini adalah bubuk putih, tidak berbau dan tidak larut dalam air.
Q: Berapa massa formula dalam gram Ca3(PO4)2?
A: Massa rumus dalam gram Ca3(PO4)2 adalah 310,18 g/mol.
