Kalium sulfit (K2SO3) adalah senyawa kimia yang tersusun dari kalium, belerang, dan oksigen. Ini biasanya digunakan sebagai pengawet dalam industri makanan untuk mencegah perubahan warna dan pembusukan.
| Nama IUPAC | Kalium sulfit |
| Formula molekul | K2SO3 |
| nomor CAS | 10117-38-1 |
| Sinonim | Dipotasium sulfit; Garam dipotasium dari asam sulfat; Kalium sulfonat; Belerang dan kalium oksida |
| Di ChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/jam;;(H2,1,2,3)/q2*+1;/p-2 |
Kalium Sulfit
Formula Kalium Sulfit
Kalium sulfit memiliki rumus kimia K2SO3 yang menunjukkan bahwa ia mengandung dua atom kalium, satu atom belerang, dan tiga atom oksigen. Senyawa tersebut terbentuk melalui reaksi antara kalium hidroksida (KOH) dan sulfur dioksida (SO2). Kalium sulfit merupakan senyawa ionik, artinya tersusun dari ion kalium bermuatan positif dan ion sulfit bermuatan negatif. Rumus ion sulfit adalah SO32-.
Massa Molar Kalium Sulfit
Massa molar K2SO3 adalah 158,26 g/mol. Ini dihitung dengan menjumlahkan massa atom setiap unsur dalam rumus (2 x massa atom K) + massa atom S + (3 x massa atom O). Massa molar suatu senyawa penting karena membantu menghitung jumlah senyawa yang diperlukan untuk reaksi tertentu atau menentukan konsentrasi suatu larutan.
Titik didih kalium sulfit
K2SO3 tidak mempunyai titik didih tertentu karena terurai sebelum mencapai titik didihnya. Namun bila dipanaskan, K2SO3 mengalami dekomposisi termal membentuk kalium sulfat (K2SO4) dan sulfur dioksida (SO2). Suhu dekomposisi sekitar 390°C.
Titik Leleh Kalium Sulfit
Titik leleh K2SO3 sekitar 350°C. Pada suhu ini, senyawa padat berubah menjadi cair. Namun seiring meningkatnya suhu, K2SO3 terurai, seperti yang disebutkan sebelumnya.
Massa jenis kalium sulfit g/mL
Massa jenis K2SO3 adalah 2,44 g/mL pada suhu kamar. Massa jenis didefinisikan sebagai massa suatu zat per satuan volume. Kepadatan K2SO3 yang tinggi menunjukkan bahwa K2SO3 merupakan senyawa yang relatif berat. Sifat ini penting dalam menentukan sifat fisik suatu senyawa, seperti kelarutan dan reaktivitasnya.
Berat Molekul Kalium Sulfit
Berat molekul K2SO3 adalah 158,26 g/mol. Nilai ini mewakili massa rata-rata suatu molekul senyawa. Berat molekul penting untuk menghitung jumlah suatu zat dalam volume atau massa tertentu, yang berguna dalam reaksi kimia dan eksperimen laboratorium.
Struktur kalium sulfit
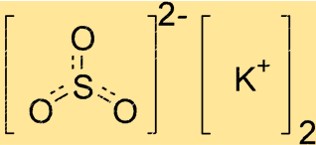
K2SO3 memiliki struktur kristal, artinya atom-atomnya tersusun dalam pola yang berulang. Senyawa ini mempunyai geometri trigonal planar, dengan atom belerang di tengah dan tiga atom oksigen tersusun simetris di sekelilingnya. Ion kalium terletak di luar struktur ini, menyeimbangkan muatan negatif ion sulfit.
Kelarutan kalium sulfit
K2SO3 sangat larut dalam air. Pada suhu kamar, ia dapat larut dalam air membentuk larutan bening dan tidak berwarna. Kelarutan K2SO3 disebabkan oleh sifat ioniknya, yang memungkinkannya berdisosiasi menjadi ion-ion penyusunnya dalam air. Kelarutan K2SO3 juga dipengaruhi oleh suhu, kelarutan meningkat seiring dengan peningkatan suhu.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 2.44 |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 158,26 g/mol |
| Kepadatan | 2,44 gram/ml |
| Titik fusi | 350°C |
| Titik didih | Terurai pada suhu 390°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut dalam air |
| Kelarutan | Larut dalam etanol dan gliserol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 10.3 (untuk asam sulfat) |
| pH | ~9 (untuk larutan 0,1 M) |
Keamanan dan Bahaya Kalium Sulfit
K2SO3 relatif aman untuk ditangani dan digunakan jika tindakan pencegahan yang tepat dilakukan. Namun, hal ini dapat menimbulkan bahaya jika tidak ditangani dengan hati-hati. Senyawa tersebut dapat menyebabkan iritasi pada kulit, mata, dan sistem pernapasan jika bersentuhan dengan bagian tubuh tersebut. K2SO3 juga dapat menyebabkan masalah pencernaan jika tertelan. Selain itu, senyawa tersebut berpotensi menimbulkan bahaya kebakaran dan ledakan jika terkena panas atau nyala api. Oleh karena itu, tindakan keselamatan yang tepat harus diambil saat bekerja dengan K2SO3, seperti memakai peralatan pelindung dan menyimpan senyawa jauh dari panas dan sumber api.
| Simbol bahaya | Tengkorak dan tulang bersilang |
| Deskripsi Keamanan | Beracun, berbahaya jika tertelan, mengiritasi kulit dan mata |
| Nomor identifikasi PBB | PBB 2697 |
| kode HS | 283210 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II (Bahaya sedang) |
| Toksisitas | Lisan (LD50): 345 mg/kg (tikus) |
Metode sintesis kalium sulfit
K2SO3 dapat disintesis dengan berbagai metode, antara lain reaksi kalium hidroksida dengan sulfur dioksida atau sulfur, reaksi kalium karbonat dengan sulfur dioksida, dan reaksi kalium bisulfit dengan hidroksida. kalium.
Pada metode pertama, larutan kalium hidroksida bereaksi dengan gas sulfur dioksida dengan adanya air membentuk K2SO3. Pada metode kedua, campuran kalium karbonat dan sulfur dioksida dipanaskan hingga suhu tinggi sehingga menghasilkan K2SO3. Metode ketiga melibatkan pencampuran kalium bisulfit dengan kalium hidroksida untuk menghasilkan K2SO3 dan air.
Metode umum lainnya untuk mensintesis K2SO3 adalah reaksi sulfur dioksida dengan garam kalium, seperti kalium klorida, dengan adanya zat pereduksi seperti natrium hidrosulfit atau besi(II) sulfat. Metode ini sering digunakan dalam lingkungan industri untuk menghasilkan K2SO3 dalam jumlah besar.
Kegunaan Kalium Sulfit
K2SO3 memiliki beberapa aplikasi di berbagai industri karena sifat kimianya. Berikut beberapa kegunaan umum K2SO3:
- Industri makanan dan minuman: digunakan sebagai pengawet makanan untuk mencegah pembusukan dan perubahan warna makanan seperti anggur, buah-buahan kering dan udang.
- Fotografi: Digunakan sebagai bahan pengikat fotografi untuk mencegah perkembangan lebih lanjut dari film dan membuat gambar menjadi permanen.
- Pengolahan Air: Digunakan sebagai zat pereduksi untuk menghilangkan klorin dari air dan untuk mengolah air limbah.
- Industri kertas: Digunakan sebagai bahan pemutih untuk menghilangkan kotoran dan memutihkan pulp dalam proses pembuatan kertas.
- Industri tekstil: Digunakan sebagai zat pereduksi untuk menghilangkan kelebihan pewarna dari kain dan untuk memutihkan tekstil.
- Industri kimia: digunakan sebagai zat pereduksi dalam reaksi kimia untuk mengubah zat pengoksidasi menjadi zat pereduksi.
- Industri Obat: Digunakan dalam beberapa perawatan medis untuk mencegah atau meringankan gejala kondisi tertentu.
Pertanyaan:
Q: Apa rumus kalium sulfit?
A: Rumus kalium sulfit adalah K2SO3.
T: Apakah kalium sulfat termasuk sulfit?
J: Tidak, kalium sulfat bukanlah sulfit. Ini adalah garam yang terdiri dari kalium, belerang dan oksigen dengan rumus kimia K2SO4.
Q: Garam apa yang dihasilkan jika H2SO4 bereaksi dengan NaOH? K2SO3, Na2SO4, Na2SO3, K2SO4
A: Jika H2SO4 bereaksi dengan NaOH, garam yang dihasilkan adalah Na2SO4.
Q: Berapa jumlah ion SO32 yang terkandung dalam 99,6 mg Na2SO3?
Massa molar Na2SO3 adalah 126,05 g/mol. A: Untuk menghitung jumlah ion SO32-, kita perlu mencari jumlah mol Na2SO3 terlebih dahulu: 99,6 mg / 126,05 g/mol = 0,000789 mol. Karena Na2SO3 mengandung dua ion SO32- per molekul, jumlah ion SO32- dalam 0,000789 mol Na2SO3 adalah 0,000789 mol x 2 = 0,00158 mol. Jadi, terdapat 0,00158 mol x 6,022 x 10^23 ion/mol = 9,52 x 10^20 SO32- ion dalam 99,6 mg Na2SO3.
Q: Berapa jumlah ion natrium dalam 99,6 mg Na2SO3? Massa molar Na2SO3 adalah 126,05 g/mol.
A: Untuk menghitung jumlah ion natrium, pertama-tama kita perlu mencari jumlah mol Na2SO3: 99,6 mg / 126,05 g/mol = 0,000789 mol. Karena setiap molekul Na2SO3 mengandung dua ion natrium, maka jumlah ion natrium dalam 0,000789 mol Na2SO3 adalah 0,000789 mol x 2 = 0,00158 mol. Jadi, terdapat 0,00158 mol x 6,022 x 10^23 ion/mol = 9,52 x 10^20 ion natrium dalam 99,6 mg Na2SO3.
Q: Apa nama kimia Na2SO3?
A: Nama kimia Na2SO3 adalah natrium sulfit.
Q: Apa nama senyawa yang rumusnya Na2SO3?
A: Nama senyawa dengan rumus Na2SO3 adalah natrium sulfit.
