Kalium sulfat (K2SO4) merupakan senyawa yang mengandung kalium, belerang dan oksigen. Ini biasanya digunakan sebagai pupuk untuk memberikan nutrisi penting bagi tanaman dan meningkatkan kualitas tanah.
| Nama IUPAC | Kalium sulfat |
| Formula molekul | K2SO4 |
| nomor CAS | 7778-80-5 |
| Sinonim | Asam sulfat, garam dikalium; Dipotasium sulfat; misterius; Asam sulfat, garam kalium (1:2); kalium sulfat; sal polikrestum; duplikat misterius |
| Di ChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/jam;;(H2,1,2,3,4)/q2*+1;/p-2 |
Sifat kalium sulfat
Rumus kalium sulfat
Rumus kimia kalium sulfat adalah K2SO4. Artinya setiap molekul kalium sulfat mengandung dua atom kalium, satu atom belerang, dan empat atom oksigen. Rumus kalium sulfat berguna untuk menentukan stoikiometri reaksi yang melibatkan senyawa, serta untuk menghitung jumlah kalium sulfat yang diperlukan untuk aplikasi tertentu.
Massa Molar Kalium Sulfat
K2SO4 memiliki massa molar sekitar 174,259 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom setiap unsur dalam senyawa, yaitu dua atom kalium, satu atom belerang, dan empat atom oksigen. Massa molar merupakan nilai yang berguna untuk menentukan jumlah K2SO4 yang dibutuhkan untuk aplikasi tertentu, seperti produksi pupuk atau percobaan laboratorium.
Titik didih kalium sulfat
Titik didih K2SO4 kira-kira 1.690 °C (3.074 °F). Ini adalah suhu di mana senyawa berubah dari cair menjadi gas. Titik didih K2SO4 yang tinggi membuatnya berguna untuk aplikasi yang memerlukan stabilitas suhu tinggi, seperti dalam produksi pupuk dan bahan kimia industri.
Titik Leleh Kalium Sulfat
Titik leleh K2SO4 kira-kira 1,069 °C (1,956 °F). Ini adalah suhu di mana senyawa padat berubah menjadi cair. Titik leleh K2SO4 yang relatif tinggi membuatnya berguna untuk aplikasi suhu tinggi, seperti produksi kaca, keramik, dan pupuk.
Massa jenis kalium sulfat g/mL
Massa jenis K2SO4 kira-kira 2,66 g/mL pada suhu kamar. Artinya satu mililiter K2SO4 beratnya 2,66 gram. Massa jenis K2SO4 bergantung pada suhu dan tekanan dan dapat digunakan untuk menghitung massa atau volume senyawa yang diperlukan untuk aplikasi tertentu.
Berat Molekul Kalium Sulfat
Berat molekul K2SO4 adalah 174,259 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom semua unsur dalam senyawa. Berat molekul berguna untuk menghitung jumlah K2SO4 yang dibutuhkan untuk aplikasi tertentu, seperti pada pupuk atau bahan kimia industri.
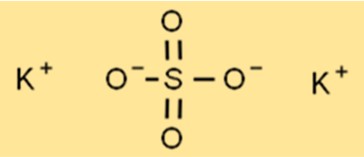
Struktur kalium sulfat
Struktur K2SO4 merupakan struktur kisi kristal, dengan setiap ion kalium dikelilingi oleh enam ion oksigen berbentuk oktahedral. Atom belerang terletak di tengah kisi, dengan setiap atom belerang dikelilingi oleh empat ion oksigen dalam bentuk tetrahedral. Struktur kisi ini memberikan sifat khas pada K2SO4, seperti titik leleh dan titik didih yang tinggi.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,66 pada 20°C |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 174,259 g/mol |
| Kepadatan | 2,66 g/cm³ pada 20°C |
| Titik fusi | 1069°C (1956°F) |
| Titik didih | 1.690°C (3.074°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 111 g/L pada 20°C |
| Kelarutan | Larut dalam air, tidak larut dalam etanol |
| Tekanan uap | 0,0 mmHg pada 25°C |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 1: 2.17; tanggal 2: 07:20; 3: 11.8 |
| pH | 5.5-8.5 (larutan 1%) |
Keamanan dan bahaya kalium sulfat
K2SO4 umumnya dianggap aman untuk digunakan di lingkungan industri, pertanian, dan laboratorium. Namun senyawa tersebut dapat menyebabkan iritasi atau kerusakan pada kulit, mata, dan sistem pernapasan jika tertelan atau terhirup dalam jumlah banyak. Selain itu, K2SO4 dapat bereaksi dengan bahan kimia tertentu, seperti asam kuat, menghasilkan asap atau kebakaran yang berbahaya. Penting untuk menangani K2SO4 dengan hati-hati, menggunakan peralatan pelindung yang sesuai dan mengikuti petunjuk keselamatan. Penyimpanan K2SO4 sebaiknya di tempat sejuk, kering, berventilasi baik, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | S24/25: Hindari kontak dengan kulit dan mata. |
| Nomor identifikasi PBB | PBB 6066 |
| kode HS | 3104.30.00 |
| Kelas bahaya | Tidak berbahaya untuk transportasi |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis kalium sulfat
Ada beberapa metode untuk mensintesis K2SO4.
Metode yang umum melibatkan reaksi kalium klorida dengan asam sulfat . Reaksi tersebut menghasilkan K2SO4 dan hidrogen klorida sebagai produk sampingan.
Metode lain melibatkan reaksi kalium hidroksida dengan asam sulfat . Reaksi ini juga menghasilkan K2SO4 dan air sebagai produk samping.
K2SO4 juga dapat diperoleh dari mineral langbeinit, yaitu mineral alami yang mengandung K2SO4, magnesium sulfat, dan natrium klorida. Biasanya, penambang mengekstraksi mineral dan mengolahnya untuk menghilangkan kotoran dan memisahkan K2SO4.
Metode lain untuk memproduksi K2SO4 melibatkan reaksi kalium karbonat dengan asam sulfat . Reaksi ini menghasilkan K2SO4 dan karbon dioksida sebagai produk sampingan.
Kegunaan Kalium Sulfat
K2SO4 memiliki cakupan aplikasi yang luas di berbagai industri. Berikut beberapa kegunaan K2SO4 yang paling umum:
- Pupuk: Pupuk yang populer karena kandungan kaliumnya yang tinggi. Digunakan untuk menanam buah-buahan, sayuran dan tanaman lainnya.
- Industri kaca: Digunakan sebagai fluks dalam produksi kaca. Ini membantu menurunkan titik leleh kaca dan meningkatkan daya tahannya.
- Industri farmasi: digunakan sebagai komponen dalam berbagai pengobatan, termasuk obat pencahar dan larutan pengganti elektrolit.
- Industri makanan: Digunakan sebagai bahan tambahan makanan untuk mengatur keasaman dan sebagai zat sisa pada makanan yang dipanggang.
- Aplikasi Industri: Digunakan dalam beberapa aplikasi industri, termasuk produksi aluminium, kalium karbonat dan bahan kimia lainnya.
- Pakan Ternak: Digunakan sebagai suplemen makanan untuk ternak dan unggas untuk meningkatkan pertumbuhan dan perkembangan yang sehat.
- Pengolahan Air: Digunakan dalam pengolahan air untuk mengendalikan kerak dan korosi pada boiler dan peralatan lainnya.
Pertanyaan:
T: Apakah kalium sulfat larut?
A: Ya, K2SO4 larut dalam air. Ia memiliki kelarutan sekitar 111 g/L pada suhu kamar.
T: Apa produk padatnya jika strontium bromida dan kalium sulfat bereaksi?
A: Ketika strontium bromida dan K2SO4 bereaksi, produk padat yang terbentuk adalah strontium sulfat (SrSO4) yang merupakan padatan putih yang tidak larut.
Q: Apa lagi yang dihasilkan dalam reaksi penggantian perak nitrat dan kalium sulfat?
A: Dalam reaksi penggantian perak nitrat dan K2SO4, perak sulfat (Ag2SO4) dan kalium nitrat (KNO3) juga diproduksi.
Q: Apakah kalium sulfat termasuk asam atau basa?
Jawaban: K2SO4 bukanlah asam atau basa, melainkan garam. Ini terbentuk dari reaksi netralisasi antara asam (asam sulfat) dan basa (kalium hidroksida).
Q: Apakah k2so4 larut dalam air?
A: Ya, K2SO4 larut dalam air. Ini sangat larut dan kelarutannya meningkat seiring dengan suhu.
Q: Garam apa yang dihasilkan jika h2so4 bereaksi dengan naoh? k2so3 na2so4 na2so3 k2so4 A: Ketika H2SO4 bereaksi dengan NaOH, garam yang dihasilkan adalah Na2SO4 (natrium sulfat) dengan air.
Q: Berapa mol k2so4 dalam 15,0 g k2so4?
A: Untuk menentukan jumlah mol K2SO4 dalam 15,0 g K2SO4, kita perlu membagi massa tertentu dengan massa molar K2SO4 yaitu 174,259 g/mol. Jadi jumlah mol K2SO4 dalam 15,0 g adalah 0,086 mol.
Q: Apa rumus endapan yang terbentuk jika pb(no3)2 (aq) dan k2so4 (aq) dicampur?
A: Apabila Pb(NO3)2 (aq) dan K2SO4 (aq) dicampur, maka endapan yang terbentuk adalah PbSO4 (timbal sulfat), yaitu padatan berwarna putih yang tidak larut. Persamaan setimbang untuk reaksi ini adalah Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
