Kalium peroksida (K2O2) adalah senyawa yang terbuat dari kalium dan oksigen. Ia sering digunakan sebagai zat pengoksidasi kuat di industri dan laboratorium untuk memfasilitasi berbagai reaksi kimia.
| Nama IUPAC | Kalium peroksioksidanida |
| Formula molekul | K2O2 |
| nomor CAS | 17014-71-0 |
| Sinonim | Kalium superoksida; Dipotasium dioksida; Kalium dioksida; Perkalium oksida |
| Di ChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Sifat kalium peroksida
Formula Kalium Peroksida
Rumus kimia kalium peroksida adalah K2O2. Rumus ini mewakili jumlah dan jenis atom yang ada dalam molekul. Rumusnya penting untuk mengidentifikasi suatu zat dan memahami sifat kimianya.
Massa Molar Kalium Peroksida
Massa molar K2O2 adalah 110,2 g/mol. Artinya satu mol K2O2 beratnya 110,2 gram. Massa molar adalah sifat penting suatu zat karena memungkinkan Anda menghitung jumlah suatu zat yang ada dalam massa atau volume tertentu.
Titik didih kalium peroksida
K2O2 tidak mempunyai titik didih tertentu, karena terurai sebelum mencapai titik didihnya. Pada suhu tinggi, K2O2 terurai menjadi kalium oksida dan gas oksigen. Oleh karena itu, umumnya tidak digunakan dalam aplikasi suhu tinggi.
Titik Leleh Kalium Peroksida
Titik leleh K2O2 adalah 655°C. Titik leleh yang tinggi ini menjadikannya zat pengoksidasi yang cocok dalam reaksi suhu tinggi. Namun, penting untuk diingat bahwa ia dapat terurai sebelum mencapai titik lelehnya jika terkena suhu atau kelembapan tinggi.
Massa jenis kalium peroksida g/mL
Massa jenis K2O2 adalah 2,08 g/mL. Kepadatan yang tinggi ini menjadikannya padatan padat yang tenggelam dalam air. Kepadatan K2O2 juga penting dalam menentukan kelarutannya dalam berbagai pelarut.
Berat Molekul Kalium Peroksida
Berat molekul K2O2 adalah 110,2 g/mol. Nilai ini merupakan jumlah dari berat atom seluruh atom yang ada dalam molekul. Berat molekul adalah properti penting yang digunakan untuk menghitung berbagai sifat suatu zat, termasuk massa molar dan kepadatannya.
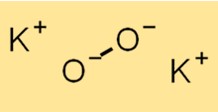
Struktur kalium peroksida
Struktur K2O2 terdiri dari kation K+ dan anion O2^2-. Anion O2^2- terdiri dari dua atom oksigen yang terikat secara kovalen. Struktur K2O2 penting untuk memahami sifat kimia dan reaktivitasnya.
| Penampilan | Padatan berwarna putih hingga kuning pucat |
| Berat jenis | 2.08 |
| Warna | Putih hingga kuning pucat |
| Bau | Tidak berbau |
| Masa molar | 110,2 g/mol |
| Kepadatan | 2,08 gram/ml |
| Titik fusi | 655°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan air |
| Kelarutan | Tidak larut dalam pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Kalium Peroksida
K2O2 menimbulkan beberapa risiko keamanan karena sifat pengoksidasinya yang kuat. Ia dapat bereaksi kuat dengan air atau uap air, melepaskan gas oksigen dan menghasilkan panas. Reaksi ini berpotensi menimbulkan kebakaran atau ledakan jika tidak ditangani dengan benar. Selain itu, dapat menyebabkan iritasi kulit dan mata jika bersentuhan, dan menghirup debunya dapat menyebabkan masalah pernafasan. Penting untuk menangani K2O2 dengan hati-hati, memakai alat pelindung diri yang sesuai dan menyimpannya di tempat sejuk dan kering, jauh dari sumber panas dan bahan yang tidak kompatibel. Jika terjadi paparan yang tidak disengaja, segera dapatkan bantuan medis.
| Simbol bahaya | Agen pengoksidasi |
| Deskripsi Keamanan | Jangan sampai terkena air. Kenakan sarung tangan pelindung dan pelindung mata/wajah. Simpan di tempat sejuk dan kering, jauh dari sumber panas dan bahan yang tidak kompatibel. |
| Nomor identifikasi PBB | UN1504 |
| kode HS | 2829.90.90 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Dapat menyebabkan iritasi kulit dan mata. Menghirup debu dapat menyebabkan gangguan pernafasan. |
Metode sintesis kalium peroksida
Ada beberapa metode untuk mensintesis K2O2, antara lain reaksi kalium hidroksida dengan hidrogen peroksida , reaksi kalium hidroksida dengan barium peroksida, dan dekomposisi termal kalium superoksida.
Cara pertama adalah dengan menambahkan kalium hidroksida secara perlahan ke dalam larutan hidrogen peroksida sambil diaduk hingga terbentuk endapan putih K2O2. Prosesnya melibatkan penyaringan campuran dan mencuci padatan dengan air dingin untuk menghilangkan kotoran.
Pada cara kedua, aduk suspensi barium peroksida sambil menambahkan larutan kalium hidroksida . Saring campuran tersebut dan uapkan filtratnya hingga kering. Kemudian panaskan padatan yang dihasilkan ke suhu tinggi untuk menguraikan sisa barium peroksida dan membentuk K2O2.
Metode ketiga melibatkan pemanasan kalium superoksida pada suhu tinggi, menyebabkannya terurai menjadi K2O2 dan gas oksigen.
Kegunaan Kalium Peroksida
K2O2 memiliki beberapa kegunaan di berbagai industri karena sifat pengoksidasinya. Beberapa kegunaannya antara lain:
- Pemutih: Digunakan sebagai bahan pemutih untuk tekstil dan produk kertas, serta produk pemutih rambut dan gigi.
- Sumber Oksigen: Digunakan sebagai sumber oksigen dalam sistem tertutup, seperti di kapal selam, yang dapat melepaskan oksigen bila bercampur dengan air.
- Polimerisasi: Digunakan dalam polimerisasi monomer tertentu untuk menghasilkan polimer, seperti dalam sintesis polistiren.
- Remediasi Tanah: Digunakan untuk remediasi tanah untuk menghilangkan kontaminan organik, seperti tumpahan minyak.
- Kimia Analitik: Digunakan dalam kimia analitik sebagai zat pengoksidasi untuk menentukan keberadaan senyawa tertentu.
- Bahan Bakar Roket: Digunakan sebagai oksidator dalam bahan bakar roket karena kemampuannya melepaskan oksigen.
- Sintesis kimia: Digunakan dalam sintesis berbagai senyawa organik dan anorganik, seperti sintesis kalium permanganat.
Pertanyaan:
T: Mana yang lebih baik, hidrogen peroksida atau kalium hidroksida?
J: Itu tergantung pada tujuan penggunaan. Hidrogen peroksida adalah zat pengoksidasi kuat dan umumnya digunakan sebagai desinfektan, pemutih, serta pemutih rambut dan gigi. Kalium hidroksida, sebaliknya, merupakan basa kuat dan umumnya digunakan dalam produksi sabun dan deterjen, serta dalam produksi biodiesel dari minyak nabati.
T: Apa rumus kimia kalium superoksida, kalium peroksida, dan kalium oksida?
A: Rumus kimianya adalah K2O2 untuk kalium superoksida, K2O2 untuk kalium peroksida, dan K2O untuk kalium oksida.
T: Apa yang terbentuk jika hidrogen peroksida bereaksi dengan kalium iodida dan iodat?
A: Ketika hidrogen peroksida bereaksi dengan kalium iodida dan iodat, yodium dihasilkan berdasarkan reaksi berikut: H2O2 + KI + KIO3 → I2 + K2O + H2O.
Q: Berapakah bilangan oksidasi atom oksigen pada K2O2?
A: Bilangan oksidasi atom oksigen pada K2O2 adalah -1.
Q: Berapa bilangan oksidasi K dalam K2O2?
A: Bilangan oksidasi K dalam K2O2 adalah +1.
