Kalium oksida (K2O) adalah senyawa kimia yang terdiri dari dua atom kalium dan satu atom oksigen. Ini biasa digunakan dalam produksi pupuk karena kandungan potasiumnya yang tinggi.
| Nama IUPAC | Kalium oksida |
| Formula molekul | K2O |
| nomor CAS | 12136-45-7 |
| Sinonim | Kalium, dikalium oksida, kalium monoksida |
| Di ChI | InChI=1S/2K.O |
Sifat kalium oksida
Formula Kalium Oksida
Rumus kalium oksida adalah K2O. Artinya setiap molekul K2O mengandung dua atom K dan satu atom O. Rumus kalium oksida penting dalam perhitungan kimia, seperti menentukan massa molar dan stoikiometri senyawa dalam reaksi kimia.
Massa Molar Kalium Oksida
K2O memiliki massa molar 94,2 g/mol. Artinya satu mol K2O mengandung 94,2 gram senyawa tersebut. Massa molar suatu senyawa penting dalam banyak perhitungan kimia, seperti menentukan jumlah senyawa yang diperlukan untuk suatu reaksi atau massa sampel senyawa tersebut.
Titik didih kalium oksida
K2O memiliki titik didih tinggi yaitu 3.150 °C (5.720 °F). Titik didih yang tinggi ini disebabkan oleh ikatan ionik yang kuat antara atom kalium dan oksigen senyawa tersebut. K2O berbentuk padat pada suhu dan tekanan kamar, namun pada suhu yang sangat tinggi dapat menguap menjadi gas.
Titik Leleh Kalium Oksida
Titik leleh K2O adalah 740°C (1.364°F). Artinya pada suhu di atas 740°C, K2O akan meleleh dan menjadi cair. Titik leleh K2O relatif tinggi dibandingkan senyawa ionik lainnya, seperti natrium klorida (801°C) dan magnesium oksida (2852°C).
Massa jenis kalium oksida g/ml
Massa jenis K2O adalah 2,32 g/cm³. Massa jenis ini lebih besar dibandingkan massa jenis air (1 g/cm³) dan menunjukkan bahwa K2O merupakan senyawa yang relatif padat. Tingginya kepadatan K2O disebabkan oleh kedekatan atom kalium dan oksigen dalam struktur kisi kristal senyawa tersebut.
Berat Molekul Kalium Oksida
Berat molekul K2O adalah 94,2 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu molekul senyawa. Berat molekul K2O penting dalam perhitungan stoikiometri, seperti menentukan jumlah reaktan yang diperlukan untuk suatu reaksi kimia.
Struktur kalium oksida
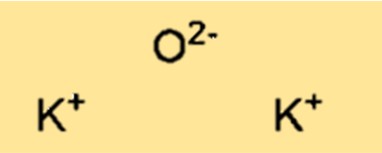
K2O memiliki struktur kisi kristal. Strukturnya terdiri dari kation kalium (K+) dan anion oksida (O2-) yang tersusun dalam pola berulang tiga dimensi. Struktur kisi kristal K2O penting dalam menentukan sifat fisik dan kimia suatu senyawa.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2.32 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 94,2 g/mol |
| Kepadatan | 2,32 gram/cm³ |
| Titik fusi | 740°C (1364°F) |
| Titik didih | 3.150°C (5.720°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi hebat dengan air |
| Kelarutan | Tidak larut dalam pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Kalium Oksida
K2O menghadirkan beberapa risiko dan bahaya keselamatan. Ia bereaksi hebat dengan air, melepaskan sejumlah besar panas dan menghasilkan kalium hidroksida. Reaksi ini dapat menyebabkan luka bakar dan kebakaran, sehingga penting untuk menangani K2O dengan hati-hati. Menghirup atau menelan K2O dapat menyebabkan iritasi pada sistem pernafasan, mata dan kulit. Selain itu, suhu tinggi yang diperlukan untuk melelehkan atau menguapkan K2O dapat menimbulkan bahaya luka bakar atau kebakaran. Oleh karena itu, peralatan pelindung yang sesuai, termasuk sarung tangan, kacamata dan respirator, harus dipakai saat menangani K2O untuk meminimalkan risiko ini.
| Simbol bahaya | Oksidasi, Korosif |
| Deskripsi Keamanan | Jauhkan dari air, jangan dihirup, pakai alat pelindung |
| Nomor identifikasi PBB | PBB 2257 |
| kode HS | 2815.20 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Korosif terhadap kulit dan mata, jika terhirup dapat menyebabkan iritasi saluran pernapasan |
Metode sintesis kalium oksida
Berbagai metode dapat mensintesis K2O.
Metode yang umum dilakukan adalah dengan memanaskan kalium karbonat, K2CO3 , pada suhu tinggi dengan adanya oksigen. Proses ini menghasilkan K2O, karbon dioksida dan uap air.
Metode lain melibatkan reaksi logam kalium dengan gas oksigen, menghasilkan K2O dan melepaskan sejumlah besar panas dalam prosesnya.
Reaksi antara KOH dan oksida logam, seperti oksida tembaga atau oksida besi, dapat menghasilkan K2O. Reaksi menghasilkan logam hidroksida dan K2O yang sesuai.
Logam kalium bereaksi dengan air menghasilkan kalium hidroksida dan gas hidrogen, menghasilkan sintesis K2O. Dehidrasi kalium hidroksida menyebabkan pembentukan K2O.
Dalam metode pengendapan uap kimia, reaktor suhu tinggi memasukkan gas yang mengandung kalium dan oksigen untuk mensintesis K2O. Gas tersebut mengalami reaksi kimia menghasilkan K2O, yang diendapkan pada permukaan substrat.
Kegunaan Kalium Oksida
K2O memiliki banyak kegunaan di berbagai industri karena sifat kimia dan fisiknya. Berikut beberapa kegunaan umum K2O:
- Produksi Pupuk: Elemen penting dalam produksi pupuk. Ini membantu tanaman tumbuh dan menjaga kesehatannya.
- Pembuatan kaca: Digunakan dalam pembuatan kaca untuk mengurangi suhu leleh dan meningkatkan kekuatan mekanik kaca.
- Metalurgi: Digunakan dalam metalurgi untuk menghasilkan logam seperti titanium dan aluminium. Ini membantu menghilangkan kotoran dan meningkatkan kualitas produk akhir secara keseluruhan.
- Industri Perminyakan: Digunakan dalam industri perminyakan sebagai katalis dalam produksi metanol dan bahan kimia lainnya.
- Baterai: Produsen baterai menggunakan K2O sebagai elektrolit dalam produksi baterai, khususnya baterai alkaline.
- Desikan: Ini adalah pengering yang kuat. Digunakan untuk menghilangkan kelembapan dari bahan, seperti pelarut, bahan bakar, dan gas.
- Reagen Laboratorium: Juga digunakan sebagai reagen laboratorium untuk berbagai reaksi dan proses kimia.
Pertanyaan:
T: Apa rumus kimia kalium oksida?
A: Rumus kimia kalium oksida adalah K2O.
T: Apa rumus kalium oksida?
A: Rumus kalium oksida adalah K2O.
T: Apakah kalium oksida larut dalam air?
J: Ya, K2O larut dalam air, meskipun bereaksi kuat dengan air menghasilkan kalium hidroksida.
Q: Berapa gram kalium permanganat yang diperlukan untuk mengoksidasi 2 g toluena secara sempurna?
A: Jumlah gram kalium permanganat yang diperlukan untuk mengoksidasi sempurna 2 g toluena bergantung pada kondisi reaksi dan stoikiometri. Persamaan seimbang dan kondisi reaksi diperlukan untuk menentukan jumlah kalium permanganat yang dibutuhkan.
Q: Apakah K2O bersifat ionik atau kovalen?
J: K2O adalah senyawa ionik yang tersusun dari kation K+ dan anion O2-.
T: Apa itu K2O?
J: K2O adalah rumus kimia untuk kalium oksida, senyawa ionik yang banyak digunakan dalam industri.
Q: Jenis obligasi apakah K2O itu?
A: Ikatan antara kalium dan oksigen dalam K2O bersifat ionik.
