Kalium klorida (KCl) merupakan senyawa yang mengandung kalium dan klor. Ini digunakan sebagai pupuk, bahan tambahan makanan, dan pengobatan medis untuk kadar kalium rendah. Ini juga dapat digunakan dalam suntikan mematikan.
| Nama IUPAC | Potasium klorida |
| Formula molekul | KCl |
| nomor CAS | 7447-40-7 |
| Sinonim | KCl, Kalium Kloratum, Muriat Kalium, Silfit, Kloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| Di ChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Formula Kalium Klorida
Rumus kimia kalium klorida adalah KCl. Ini adalah senyawa biner yang terdiri dari satu atom kalium dan satu atom klor. Rumus kalium klorida penting untuk memahami sifat kimianya dan untuk melakukan perhitungan terkait penggunaannya dalam berbagai aplikasi.
Massa molar kalium klorida
Massa molar KCl adalah 74,55 g/mol. Ini adalah padatan kristal putih dengan rasa asin dan sangat larut dalam air. KCl adalah senyawa yang terdiri dari satu atom kalium dan satu atom klor.
Titik didih kalium klorida
Titik didih KCl adalah 1.420 °C (2.588 °F). Ini adalah senyawa dengan titik leleh tinggi yang membutuhkan energi besar untuk mencapai titik didihnya. Titik didih KCl yang tinggi membuatnya berguna dalam aplikasi suhu tinggi, seperti produksi keramik dan kaca.
Titik lebur KCl
Titik leleh KCl adalah 770°C (1.418°F). Ini adalah senyawa dengan titik leleh yang relatif tinggi yang membutuhkan panas yang signifikan untuk meleleh. KCl digunakan dalam produksi pupuk dan titik lelehnya yang tinggi membantu memastikan stabilitasnya pada suhu tinggi.
Massa jenis KCl g/ml
Massa jenis KCl adalah 1,98 g/cm³. Ini adalah senyawa yang relatif padat, artinya sejumlah kecil mengandung sejumlah besar partikel. Kepadatan KCl yang tinggi membuatnya berguna dalam aplikasi industri tertentu, seperti dalam produksi cairan pengeboran.
Berat molekul KCl
Berat molekul KCl adalah 74,55 g/mol. Ini adalah senyawa yang relatif ringan, artinya mengandung sejumlah kecil partikel. Berat molekul KCl yang rendah membuatnya mudah diangkut dan ditangani di lingkungan industri.
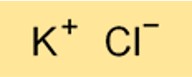
struktur KCl
Struktur KCl adalah kisi kristal ionik. Ini terdiri dari ion kalium dan klorin bergantian yang disusun dalam pola berulang. Sifat ionik dari strukturnya berarti KCl merupakan penghantar listrik yang baik bila dilarutkan dalam air.
| Penampilan | Padatan kristal putih |
| Berat jenis | 1,98 gram/cm³ |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 74,55 g/mol |
| Kepadatan | 1,98 gram/cm³ |
| Titik fusi | 770°C (1.418°F) |
| Titik didih | 1420°C (2588°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 34,7g/100ml (0°C) |
| Kelarutan | Larut dalam air, gliserol dan formamida; sedikit larut dalam etanol |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | -1,8 (asam terkonjugasi) |
| pH | 7 (larutan 10%) |
Keamanan dan Bahaya Kalium Klorida
Kalium klorida (KCl) memiliki potensi bahaya dan masalah keamanan yang harus dipertimbangkan saat menangani atau menggunakannya. Hal ini dapat menyebabkan iritasi kulit dan mata, dan paparan yang terlalu lama dapat menyebabkan luka bakar kimia. Menghirup debu KCl dapat menyebabkan iritasi pernafasan dan batuk. Selain itu, menelan KCl dalam jumlah besar dapat menyebabkan ketidakseimbangan elektrolit dan aritmia jantung. Penting untuk memakai alat pelindung diri yang sesuai, seperti sarung tangan dan pelindung mata, dan menangani KCl di area yang berventilasi baik. Jika terjadi kontak dengan kulit atau mata, penting untuk membilas area yang terkena secara menyeluruh dan berkonsultasi dengan dokter jika perlu.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Menyebabkan iritasi kulit dan mata. Berbahaya jika tertelan. |
| ID | UN1480 |
| kode HS | 310420 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | LD50 (tikus, oral): 2,500 mg/kg |
Metode sintesis kalium klorida
Beberapa metode yang dapat mensintesis kalium klorida (KCl), antara lain:
- Pelarutan dan kristalisasi: Metode ini melibatkan pelarutan KCl dalam air dan kemudian membiarkan larutan menguap, meninggalkan kristal KCl padat.
- Pertukaran ion: Untuk menghasilkan KCl, ion dalam larutan garam lain, seperti natrium klorida, dapat ditukar dengan ion kalium. Industri umumnya menggunakan metode ini dalam produksi pupuk KCl.
- Elektrolisis: Elektrolisis larutan KCl menghasilkan unsur kalium dan gas klor, yang bergabung membentuk KCl.
- Reaksi Kalium Hidroksida dengan Asam Klorida : Kalium hidroksida dapat bereaksi dengan asam klorida menghasilkan KCl dan air.
- Reaksi Kalium Karbonat dengan Asam Klorida: Kalium karbonat dapat bereaksi dengan asam klorida menghasilkan KCl, karbon dioksida, dan air.
Setiap metode memiliki kelebihan dan kekurangannya masing-masing, dan pilihan metode mungkin bergantung pada faktor-faktor seperti kemurnian produk yang diperlukan, skala produksi, dan biaya bahan baku dan peralatan.
Kegunaan Kalium Klorida
Kalium klorida memiliki berbagai kegunaan, antara lain:
- Pupuk: Digunakan sebagai pupuk untuk menyediakan nutrisi penting bagi pertumbuhan tanaman.
- Bahan tambahan makanan: Digunakan sebagai pengganti garam dalam makanan olahan untuk mengurangi asupan natrium.
- Pengolahan Air: Ditambahkan ke sistem pengolahan air untuk mencegah korosi dan pembentukan kerak.
- Aplikasi Medis: Digunakan dalam cairan intravena dan larutan rehidrasi oral untuk menggantikan elektrolit dan mengobati kondisi seperti hipokalemia.
- Aplikasi industri: Digunakan dalam produksi kaca, keramik dan sabun, dan sebagai bahan mentah dalam produksi bahan kimia lainnya.
- Pakan Ternak: Ditambahkan ke pakan ternak untuk menyediakan nutrisi penting.
- Deicing Agent: Digunakan sebagai deicing agent untuk mencairkan es dan salju di jalan dan trotoar.
- Pengeboran Minyak dan Gas: Digunakan sebagai penstabil tanah liat dalam operasi pengeboran minyak dan gas.
- Reagen Laboratorium: Digunakan sebagai reagen dalam percobaan dan analisis laboratorium.
Pertanyaan:
T: Apa itu kalium klorida?
A: Kalium klorida (KCl) adalah garam kristal putih yang tersusun dari ion kalium dan klorin. Ini memiliki banyak aplikasi dalam industri seperti pertanian, makanan, obat-obatan dan manufaktur kimia.
T: Untuk apa kalium klorida digunakan?
J: Kalium klorida umumnya digunakan sebagai pupuk, bahan tambahan makanan, dan dalam aplikasi medis untuk mengobati kondisi seperti hipokalemia. Ini juga dapat digunakan dalam pengolahan air, proses industri, pakan ternak, penghilangan lapisan es, pengeboran minyak dan gas, serta eksperimen laboratorium.
T: Apakah kalium klorida aman?
J: Kalium klorida bisa berbahaya jika tertelan dalam jumlah banyak atau jika terkena mata atau kulit. Penting untuk mengikuti pedoman dan peraturan keselamatan yang tepat saat menangani atau menggunakan kalium klorida.
Q: Apakah KCl larut dalam air?
A: Ya, KCl sangat larut dalam air. Pada suhu kamar, satu gram KCl dapat larut dalam 1,5 ml air.
Q: Apakah KCl bersifat ionik atau kovalen?
A: KCl merupakan senyawa ionik karena tersusun dari ion kalium bermuatan positif dan ion klorida bermuatan negatif yang diikat melalui ikatan ion.
Q: Apakah KCl termasuk asam atau basa?
A: Kalium klorida adalah senyawa netral dan bukan asam atau basa.
Q: Apakah KCl merupakan elektrolit kuat?
J: Ya, KCl adalah elektrolit yang kuat karena terurai sempurna menjadi ion kalium dan klorida ketika dilarutkan dalam air, sehingga menghasilkan konduktivitas listrik.
