Kalium klorat (KClO3) adalah senyawa kimia yang tersusun dari kalium, klorin, dan oksigen. Umumnya digunakan dalam pembuatan korek api, bahan peledak dan kembang api karena sifat pengoksidasinya.
| Nama IUPAC | Potasium klorida |
| Formula molekul | KClO3 |
| nomor CAS | 3811-04-9 |
| Sinonim | Kaliumklorat, Klorkalik, Kalium klorat, Kalium perklorat, UN 1485, Kalium klorat, Kalium perklorik |
| Di ChI | InChI=1S/ClH3KO3/c2-1(3)4/jam(H3,2,3,4)/p-1 |
Sifat kalium klorat
Formula Kalium Klorat
Kalium klorat memiliki rumus kimia KClO3, yang menunjukkan bahwa ia terdiri dari satu atom kalium, satu atom klor, dan tiga atom oksigen. Ini adalah senyawa ionik yang terbentuk ketika ion K+ dan ClO3- bergabung melalui ikatan ionik. Senyawa ini sangat reaktif karena adanya oksigen, sehingga memberikan sifat pengoksidasi yang kuat.
Massa Molar Kalium Klorat
Massa molar KClO3 adalah 122,55 g/mol. Ini adalah jumlah massa atom masing-masing unsur penyusun senyawa, yaitu kalium, klor, dan oksigen. Massa molar merupakan parameter penting dalam kimia karena digunakan untuk menghitung massa suatu zat yang dibutuhkan untuk menghasilkan sejumlah produk dalam suatu reaksi kimia.
Titik didih kalium klorat
KClO3 tidak memiliki titik didih yang jelas karena terurai sebelum mencapai titik didihnya. Saat dipanaskan, ia terurai menjadi kalium klorida dan gas oksigen. Oleh karena itu, KClO3 mengalami reaksi dekomposisi termal daripada titik didih.
Kalium klorat Titik lebur
Titik leleh KClO3 adalah 356°C (673°F). Pada suhu ini, senyawa padat meleleh dan berubah menjadi cair. Titik leleh merupakan sifat penting suatu senyawa karena mempengaruhi perilaku fisik suatu zat, termasuk kelarutan dan kepadatannya.
Massa jenis kalium klorat g/mL
Massa jenis KClO3 adalah 2,32 g/mL pada suhu kamar. Artinya volume spesifik suatu senyawa mempunyai massa tertentu, yang berguna dalam menentukan massa suatu zat yang diperlukan untuk suatu reaksi kimia tertentu. Kepadatan KClO3 juga mempengaruhi kelarutannya dalam air, karena senyawa dengan kepadatan lebih tinggi cenderung kurang larut dalam air.
Berat Molekul Kalium Klorat
Berat molekul KClO3 adalah 122,55 g/mol. Merupakan penjumlahan dari berat atom atom-atom penyusunnya, yaitu kalium, klor, dan oksigen. Berat molekul merupakan parameter penting dalam stoikiometri karena digunakan untuk menghitung jumlah reaktan dan produk dalam suatu reaksi kimia.
Struktur Kalium Klorat
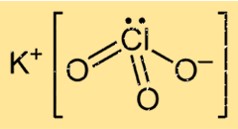
KClO3 memiliki struktur kristal dalam bentuk padat, terdiri dari atom kalium, klor, dan oksigen yang tersusun dalam pola tertentu. Senyawa tersebut membentuk struktur kisi kristal kubik berpusat muka, di mana setiap ion kalium dikelilingi oleh enam atom oksigen dan setiap ion oksigen dikelilingi oleh empat atom kalium dan dua atom klor.
Kelarutan kalium klorat
KClO3 cukup larut dalam air, dengan kelarutan 7 g/100 ml air pada suhu kamar. Kelarutan suatu senyawa meningkat seiring dengan bertambahnya suhu, karena molekul air mempunyai energi kinetik yang lebih besar dan dapat melarutkan lebih banyak senyawa. KClO3 juga larut dalam pelarut polar lainnya seperti etanol dan aseton.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,32 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 122,55 g/mol |
| Kepadatan | 2,32 gram/cm³ |
| Titik fusi | 356°C (673°F) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 7 g/100 mL pada suhu 20°C |
| Kelarutan | Larut dalam etanol dan aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | PH larutan 0,1 M kira-kira 6,5 hingga 7,5 |
Keamanan dan bahaya kalium klorat
KClO3 merupakan zat yang sangat reaktif dan berpotensi berbahaya, sehingga harus ditangani dengan sangat hati-hati. Ini dapat menyebabkan iritasi serius pada kulit dan mata dan mungkin beracun jika tertelan atau terhirup. Jika dipanaskan, dapat bereaksi hebat bahkan meledak. KClO3 juga dapat bereaksi kuat dengan bahan kimia lain, seperti asam sulfat dan senyawa organik, serta menghasilkan gas beracun seperti klorin dan klorat dioksida. Penting untuk mengikuti protokol keselamatan yang tepat saat bekerja dengan KClO3, termasuk memakai peralatan pelindung dan bekerja di area yang berventilasi baik.
| Simbol bahaya | O, Xi, N |
| Deskripsi Keamanan | Hindari kontak dengan bahan yang mudah terbakar. Beracun jika tertelan. Menyebabkan luka bakar kulit yang parah dan kerusakan mata. |
| Nomor identifikasi PBB | UN1485 |
| kode HS | 2829.90.10 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis kalium klorat
Ada beberapa metode untuk mensintesis KClO3.
Salah satu metode melibatkan reaksi antara kalium klorida dan pemutih. Metode ini melibatkan penambahan larutan pemutih ke dalam larutan kalium klorida dan mengaduk campurannya. Untuk menghasilkan KClO3, saring dan cuci endapan yang diperoleh.
Metode lain melibatkan elektrolisis larutan yang mengandung kalium klorida , air, dan sumber oksigen. Sel elektrolitik, perangkat khusus, melakukan proses ini dengan memisahkan ion kalium dan klorida dan menghasilkan gas oksigen. Oksigen bereaksi dengan ion kalium membentuk KClO3.
Metode ketiga melibatkan reaksi antara kalium hidroksida dan gas klor, yang menghasilkan KClO3 dengan kalium klorida dan air. Metode ini memerlukan kontrol suhu dan konsentrasi reagen yang cermat untuk memastikan hasil yang optimal.
Kegunaan Kalium Klorat
KClO3 memiliki kegunaan yang luas di berbagai industri, antara lain:
- Produk Kembang Api: Biasa digunakan sebagai zat pengoksidasi pada kembang api dan perangkat kembang api lainnya.
- Korek api: Digunakan pada kepala korek api pengaman, yang akan menyala jika dipukul pada permukaan yang kasar.
- Pupuk: Digunakan sebagai sumber kalium untuk pupuk tanaman.
- Pemutih: Digunakan sebagai bahan pemutih untuk tekstil, kertas dan bahan lainnya.
- Reagen Laboratorium: Juga digunakan sebagai reagen laboratorium untuk berbagai reaksi kimia.
- Aplikasi Medis: Digunakan sebagai obat untuk mengobati jenis kondisi kulit tertentu, seperti eksim.
- Bahan Peledak: Bahan umum dalam beberapa jenis bahan peledak, seperti detonator dan dinamit.
- Pengoksidasi: Digunakan sebagai zat pengoksidasi dalam produksi bahan kimia tertentu, seperti perklorat.
Pertanyaan:
Q: Berapa gram kalium klorida yang dihasilkan jika 25g kalium klorat terurai?
A: Bila 25 g KClO3 terurai menghasilkan 13,47 g kalium klorida.
T: Bagaimana cara membuat kalium klorat?
A: KClO3 dapat dibuat dengan mereaksikan kalium klorida dengan pemutih, dengan elektrolisis larutan yang mengandung kalium klorida, atau dengan mereaksikan kalium hidroksida dengan gas klor.
Q: Berapa mol oksigen yang dihasilkan ketika 2 mol kalium klorat (kclo3) terurai?
A: Bila 2 mol KClO3 terurai menghasilkan 3 mol gas oksigen.
Q: Larutan 0,70 m mengandung 3,0 g kalium klorat (kclo3). Berapa volume larutan tersebut?
A: Volume larutan 0,70 m yang mengandung 3,0 g KClO3 adalah 51,4 mL.
T: Apakah kalium klorat mudah menguap?
J: KClO3 tidak termasuk zat yang mudah menguap karena memiliki titik leleh dan titik didih yang relatif tinggi.
Q: Berapa kcl yang dihasilkan jika 2,50 g kclo3 didekomposisi?
A: Bila 2,50 g KClO3 terurai menghasilkan 1,35 g kalium klorida.
Q: Apakah kclo3 larut dalam air?
A: Ya, KClO3 sangat larut dalam air, dengan kelarutan 7 g/100 mL pada suhu kamar.
Q: Berapa gram oksigen yang dapat dihasilkan dari penguraian 100 g kclo3?
A: Apabila 100 g KClO3 terurai menghasilkan 45,02 g gas oksigen.
