Kalium karbonat (K2CO3) adalah bubuk berwarna putih tidak berbau yang biasa digunakan dalam produksi sabun, kaca, dan keramik. Ini juga dapat digunakan sebagai bahan tambahan makanan dan zat penyangga dalam industri farmasi.
| Nama IUPAC | Kalium karbonat |
| Formula molekul | K2CO3 |
| nomor CAS | 584-08-7 |
| Sinonim | Asam karbonat, garam dikalium; abu mutiara; Kalium karbonat; garam tartar; Kalium monokarbonat; Kalium hidrogen karbonat |
| Di ChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; M |
Sifat kalium karbonat
Formula Kalium Karbonat
Rumus kimia kalium karbonat adalah K2CO3. Rumus ini mewakili jumlah pasti atom setiap unsur dalam senyawa. Rumusnya dapat digunakan untuk menghitung massa molar dan sifat-sifat senyawa lainnya.
Massa Molar Kalium Karbonat
K2CO3 memiliki massa molar 138,21 g/mol. Artinya satu mol K2CO3 mengandung 138,21 gram senyawa tersebut. Massa molar penting dalam menentukan berapa banyak suatu zat yang dibutuhkan untuk reaksi atau percobaan tertentu. Ini juga digunakan untuk mengubah massa menjadi mol suatu zat.
Titik didih kalium karbonat
K2CO3 memiliki titik didih yang relatif tinggi yaitu 1.620 °C (2.948 °F). Hal ini membuatnya berguna dalam aplikasi suhu tinggi seperti produksi kaca dan keramik. Titik didih adalah suhu di mana suatu zat berubah dari cair menjadi gas.
Titik Leleh Kalium Karbonat
K2CO3 memiliki titik leleh 891°C (1.636°F). Titik leleh yang relatif tinggi ini disebabkan oleh sifat ionik senyawa tersebut. Ketika dipanaskan, ikatan ionik antara ion kalium dan karbonat harus diputus agar zat tersebut dapat meleleh.
Kepadatan Kalium Karbonat g/mL
Massa jenis K2CO3 adalah 2,43 g/mL pada suhu kamar. Artinya K2CO3 dengan volume tertentu mempunyai massa tertentu. Massa jenis suatu zat merupakan suatu sifat penting yang dapat digunakan untuk mengidentifikasi suatu zat dan menghitung massa atau volume suatu zat dalam suatu ruang tertentu.
Berat Molekul Kalium Karbonat
Berat molekul K2CO3 adalah 138,21 g/mol. Ini adalah massa satu mol senyawa, yang penting dalam banyak perhitungan kimia.
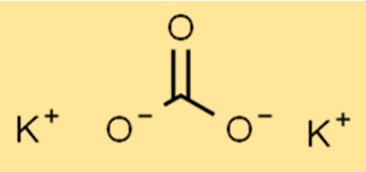
Struktur kalium karbonat
K2CO3 mempunyai struktur ionik, dengan rumus K2CO3. Ion kalium (K+) dan ion karbonat (CO32-) disatukan melalui ikatan ionik. Ion karbonat adalah ion poliatomik yang terdiri dari satu atom karbon dan tiga atom oksigen.
| Penampilan | Bubuk kristal putih |
| Kepadatan spesifik | 2.43 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 138,21 g/mol |
| Kepadatan | 2,43g/ml |
| Titik fusi | 891°C (1.636°F) |
| Titik didih | 1620°C (2948°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 112 g/100 mL pada 20°C |
| Kelarutan | Larut dalam air, gliserol dan alkohol |
| Tekanan uap | Dapat diabaikan pada suhu kamar |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 10:33 |
| pH | 11.5 (larutan berair pada 10 g/L) |
Keamanan dan Bahaya Kalium Karbonat
K2CO3 secara umum dianggap aman untuk digunakan pada produk industri dan rumah tangga. Namun, bedak ini dapat menyebabkan iritasi pada kulit dan mata, dan jika terhirup, bedak ini dapat menyebabkan iritasi saluran pernapasan. Paparan debu K2CO3 konsentrasi tinggi dalam waktu lama dapat menyebabkan kerusakan paru-paru. Penting untuk memakai alat pelindung diri yang sesuai saat menangani senyawa ini, termasuk sarung tangan, kacamata dan masker. K2CO3 tidak mudah terbakar atau meledak, namun dapat bereaksi dengan asam menghasilkan karbon dioksida, yang dapat berbahaya di ruang terbatas. Jika tertelan atau terkena kulit atau mata, segera dapatkan bantuan medis.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Kenakan sarung tangan, kacamata dan masker. Hindari kontak terlalu lama dengan kulit dan mata. Jangan menghirup bedaknya. |
| Nomor identifikasi PBB | PBB1863 |
| kode HS | 2836.40.00 |
| Kelas bahaya | Tidak berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Kalium karbonat tidak dianggap beracun, namun dapat menyebabkan iritasi pernafasan dan kulit pada konsentrasi tinggi. Paparan debu dengan konsentrasi tinggi dalam waktu lama dapat menyebabkan kerusakan paru-paru. |
Metode sintesis kalium karbonat
Berbagai metode dapat mensintesis K2CO3
Metode yang umum adalah mereaksikan kalium hidroksida dengan karbon dioksida.
Untuk mencegah keluarnya karbon dioksida, reaksi ini dapat dilakukan dalam wadah tertutup.
Metode lain melibatkan mereaksikan kalium klorida dengan natrium karbonat dalam larutan air. K2CO3 yang dihasilkan mengendap dari larutan dan dapat dikumpulkan melalui penyaringan.
Cara lain untuk mensintesis K2CO3 adalah dengan mereaksikan kalium sulfat dengan karbon dengan adanya arang. Secara historis, ahli kimia menggunakan proses Leblanc untuk memproduksi K2CO3 pada skala industri. Namun, masalah lingkungan membuat proses ini jarang terjadi saat ini, karena melepaskan sulfur dioksida.
K2CO3 dapat disintesis dari kalium bikarbonat dengan memanaskannya pada suhu tinggi, menyebabkannya terurai menjadi K2CO3 dan karbon dioksida. Oven atau oven dapat melakukan reaksi ini.
Kegunaan Kalium Karbonat
K2CO3 memiliki aplikasi yang luas di berbagai industri karena sifatnya yang unik. Beberapa kegunaan umum meliputi:
- Produksi kaca: digunakan sebagai fluks untuk menurunkan titik leleh silika dan bahan lainnya.
- Industri makanan: Digunakan sebagai bahan tambahan makanan untuk mengatur keasaman dan sebagai bahan sisa dalam pembuatan kue.
- Sabun dan Deterjen: Juga digunakan dalam pembuatan sabun dan deterjen sebagai pelembut air.
- Industri Farmasi: Digunakan sebagai zat penyangga dalam formulasi obat.
- Pupuk: Juga digunakan sebagai pupuk di bidang pertanian untuk menyediakan kalium bagi tanaman.
- Produksi keramik: Digunakan sebagai fluks untuk mengurangi suhu pembakaran dan meningkatkan kualitas produk jadi.
- Kembang Api: Digunakan dalam produksi kembang api untuk menghasilkan api ungu.
- Baterai: digunakan dalam produksi baterai sebagai elektrolit.
- Industri tekstil: Digunakan sebagai bahan pewarna.
Pertanyaan:
T: Apakah kalium karbonat larut?
A: Ya, kalium karbonat larut dalam air.
Q: Apakah K2CO3 larut dalam air?
A: Ya, K2CO3 larut dalam air. Faktanya, ia sangat larut dan dapat larut dalam air membentuk larutan bening dan tidak berwarna.
Q: Berapa gram kalium karbonat yang diperlukan untuk membuat 200 ml larutan 2,5 M?
A: Untuk menyiapkan larutan 2,5 M K2CO3 dalam 200 ml air, Anda perlu melarutkan 33,25 gram K2CO3 ke dalam air.
Perhitungan: Molaritas = mol / volume (dalam liter) 2,5 M = mol / 0,2 L mol = 0,5 massa mol = mol x massa molar massa = 0,5 mol x 138,21 g/mol massa = 33,25g
Q: Berapa konsentrasi ion K dalam larutan K2CO3 0,045 M jika diasumsikan terdisosiasi sempurna?
J: Ketika K2CO3 terdisosiasi sempurna dalam air, ia membentuk dua ion K+ dan satu ion CO3 2-. Oleh karena itu, konsentrasi ion K+ dalam larutan K2CO3 0,045 M akan menjadi dua kali molaritas larutan K2CO3, yaitu 0,090 M.
