Kalium dikromat adalah senyawa kimia berwarna oranye terang yang digunakan dalam berbagai aplikasi. Ini adalah zat pengoksidasi kuat dan dapat menjadi racun jika tertelan atau terhirup.
| Nama IUPAC | Kalium dikromat |
| Formula molekul | K2Cr2O7 |
| nomor CAS | 7778-50-9 |
| Sinonim | Kalium dikromat, Kalium kromat (VI), Kalium dikromat |
| Di ChI | InChI=1S/2Cr.2K.7O/q;;2*+1;;;;;;;/h;;2*;7*1- |
Sifat kalium dikromat
Rumus kalium dikromat
Rumus kalium dikromat adalah K2Cr2O7. Ia terdiri dari dua atom kalium (K), dua atom kromium (Cr), dan tujuh atom oksigen (O). Setiap atom kalium mempunyai muatan +1, sedangkan setiap atom kromium mempunyai muatan +6. Kehadiran dua atom kromium dalam rumus menunjukkan struktur dimer senyawa tersebut.
Massa Molar Kalium Dikromat
Massa molar kalium dikromat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Kalium memiliki massa molar 39,10 gram per mol (g/mol), kromium memiliki massa molar 52,00 g/mol, dan oksigen memiliki massa molar 16,00 g/mol. Oleh karena itu, massa molar kalium dikromat adalah 294,18 g/mol.
Titik didih kalium dikromat
Kalium dikromat tidak memiliki titik didih tertentu, karena terurai sebelum mencapai titik didih. Namun, ketika dipanaskan, ia mengalami dekomposisi termal, melepaskan asap beracun dari kromium oksida dan oksigen.
Kalium dikromat Titik lebur
Titik leleh kalium dikromat kira-kira 398 derajat Celcius (°C) atau 748 derajat Fahrenheit (°F). Pada suhu ini, kristal padat kalium dikromat berubah menjadi cair.
Massa jenis kalium dikromat g/mL
Kepadatan kalium dikromat kira-kira 2,68 gram per mililiter (g/mL). Hal ini menunjukkan bahwa volume tertentu kalium dikromat relatif lebih berat dibandingkan volume air yang sama.
Berat Molekul Kalium Dikromat
Berat molekul kalium dikromat sama dengan massa molarnya, yaitu 294,18 gram per mol (g/mol). Ini mewakili massa gabungan dari semua atom yang ada dalam molekul senyawa.
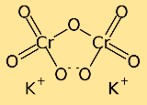
Struktur kalium dikromat
Kalium dikromat memiliki struktur dimer, artinya terdiri dari dua atom kromium yang diikat oleh atom oksigen. Atom kalium juga terikat pada atom oksigen, menciptakan jaringan atom yang kompleks dalam senyawa tersebut.
Kelarutan kalium dikromat
Kalium dikromat sangat larut dalam air. Ini mudah larut dalam air untuk membentuk larutan oranye. Kelarutan kalium dikromat meningkat seiring dengan peningkatan suhu. Namun kelarutannya dalam pelarut organik terbatas.
| Penampilan | Kristal oranye terang |
| Berat jenis | 2,68g/ml |
| Warna | Oranye |
| Bau | Tidak berbau |
| Masa molar | 294,18 g/mol |
| Kepadatan | 2,68g/ml |
| Titik fusi | 398°C (748°F) |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air, terbatas dalam pelarut organik |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | Asam (sekitar pH 4) |
Keamanan dan bahaya kalium dikromat
Kalium dikromat menimbulkan risiko keamanan yang signifikan. Ini sangat beracun jika tertelan, terhirup atau bersentuhan dengan kulit. Senyawa ini merupakan oksidator kuat yang dapat bereaksi hebat dengan bahan mudah terbakar sehingga meningkatkan risiko kebakaran. Paparan kalium dikromat dapat menyebabkan iritasi kulit yang parah, luka bakar, dan reaksi alergi. Menghirup asap atau debunya dapat menyebabkan gangguan pernafasan dan kerusakan paru-paru. Paparan jangka panjang dikaitkan dengan dampak buruk terhadap kesehatan, termasuk kanker paru-paru yang disebabkan oleh kromat. Penting untuk menangani kalium dikromat dengan sangat hati-hati, memakai peralatan pelindung yang sesuai dan memastikan ventilasi yang memadai untuk meminimalkan risiko kesehatan dan keselamatan.
| Simbol bahaya | Korosif, Bahaya kesehatan, Beracun akut |
| Deskripsi Keamanan | – Sangat beracun – Korosif – Mengakibatkan luka bakar |
| Nomor identifikasi PBB | UN 3086 (kelas 6.1) |
| kode HS | 2841.10.10 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas oral akut: Sangat beracun<br>Toksisitas kronis: Potensi karsinogenik |
Catatan: Simbol bahaya yang digunakan dalam tabel adalah simbol internasional yang umum dikenal. Penting untuk mengacu pada peraturan khusus dan petunjuk keselamatan untuk informasi lengkap mengenai penanganan dan penyimpanan kalium dikromat.
Metode sintesis kalium dikromat
Ada beberapa metode untuk mensintesis kalium dikromat. Metode yang umum digunakan melibatkan reaksi antara kalium kromat (K2CrO4) dan asam kromat (H2CrO4) . Reaksi berlangsung dalam lingkungan asam, biasanya dengan asam sulfat (H2SO4) sebagai katalis. Reaksinya dapat menyimpulkannya.
2K2CrO4 + 2H2CrO4 + 2H2SO4 → K2Cr2O7 + Cr2(SO4)3 + 4H2O
Metode lain melibatkan oksidasi kalium kromat menggunakan zat pengoksidasi kuat, seperti asam sulfat pekat (H2SO4) , dan zat pereduksi, seperti etanol (C2H5OH). Reaksinya dapat menyimpulkannya.
2K2CrO4 + H2SO4 + 3C2H5OH → K2Cr2O7 + Cr2(SO4)3 + 7H2O + 3CO2
Kalium hidroksida (KOH) bereaksi dengan kromium trioksida (CrO3) dalam media berair menghasilkan kalium dikromat. Dalam media berair, reaksi terjadi. Reaksinya dapat menyimpulkannya.
2KOH + CrO3 → K2Cr2O7 + H2O
Metode sintesis ini memerlukan tindakan pencegahan keamanan yang tepat karena sifat toksik dan korosif dari reagen yang terlibat. Penting untuk melakukan reaksi ini di area yang berventilasi baik, memakai peralatan pelindung, dan menangani bahan kimia dengan hati-hati. Selain itu, mengikuti protokol pembuangan limbah yang benar sangat penting untuk meminimalkan dampak terhadap lingkungan.
Kegunaan Kalium Dikromat
Kalium dikromat dapat diterapkan di berbagai bidang karena sifatnya yang unik. Berikut adalah beberapa kegunaan umum:
- Zat pengoksidasi: Reaksi kimia banyak menggunakan kalium dikromat sebagai zat pengoksidasi kuat untuk mengoksidasi alkohol menjadi aldehida atau keton.
- Reagen Laboratorium: Kimia analitik menggunakan kalium dikromat sebagai reagen untuk pengujian dan eksperimen, termasuk menentukan senyawa organik dan melakukan reaksi redoks.
- Industri Penyamakan Kulit: Industri kulit menggunakan kalium dikromat sebagai bahan penyamakan untuk mengolah kulit hewan dan mengubahnya menjadi produk kulit yang tahan lama.
- Fotografi: Fotografi hitam putih menggabungkan kalium dikromat ke dalam larutan pengembangan dan menggunakannya untuk menyadarkan emulsi guna mencapai efek fotografi tertentu.
- Pengawetan Kayu: Untuk melindungi kayu dari serangan pembusukan, jamur dan serangga, industri pengawetan kayu menggunakan kalium dikromat sebagai pengawet kayu yang sangat beracun.
- Manufaktur Pigmen: Kalium dikromat memainkan peran penting dalam produksi pigmen seperti kuning krom dan oranye krom, yang digunakan industri dalam cat, tinta, dan pewarna.
- Elektroplating: Proses elektroplating menggunakan kalium dikromat untuk memberikan lapisan dekoratif dan tahan korosi pada logam termasuk seng, aluminium, dan kuningan.
- Kembang api: Kalium dikromat memainkan peran penting dalam campuran kembang api, memberikan warna oranye cerah pada kembang api dan suar.
- Industri Tekstil: Pencelupan dan pencetakan tekstil menggunakan kalium dikromat untuk mencapai warna yang diinginkan dan meningkatkan ketahanan luntur warna.
- Kalibrasi peralatan gelas laboratorium: Untuk pengukuran volume yang tepat, larutan kalium dikromat digunakan untuk mengkalibrasi peralatan gelas laboratorium.
Aplikasi yang beragam ini menyoroti keserbagunaan dan pentingnya kalium dikromat dalam berbagai industri dan upaya ilmiah.
Pertanyaan:
T: Apa rumus kalium dikromat yang benar?
A: Rumus kalium dikromat yang benar adalah K2Cr2O7.
T: Apa itu kalium dikromat?
A: Kalium dikromat adalah senyawa kimia berwarna oranye terang dan umumnya digunakan sebagai zat pengoksidasi.
T: Apakah kalium dikromat bersifat ionik atau kovalen?
A: Kalium dikromat adalah senyawa ionik.
Q: Berapa jumlah minimum air yang diperlukan untuk melarutkan 3 mol kalium dikromat?
A: Jumlah minimum air yang diperlukan untuk melarutkan 3 mol kalium dikromat adalah kira-kira 564 gram.
Q: Berapa massa molar kalium dikromat?
A: Massa molar kalium dikromat adalah 294,18 gram per mol (g/mol).
T: MSDS kalium dikromat?
J: Lembar Data Keamanan Bahan (MSDS) untuk kalium dikromat memberikan informasi rinci mengenai bahaya, penanganan, penyimpanan, dan tindakan pertolongan pertama. Silakan merujuk ke sumber atau produsen terpercaya untuk MSDS tertentu.
T: Bagaimana kalium dikromat dibuat dari bijih kromit?
A: Kalium dikromat dapat dibuat dari bijih kromit dengan memanggangnya dengan kalium hidroksida atau kalium karbonat dan kemudian mengisolasi produknya.
Q: Berapa gram kalium dikromat yang ditambahkan ke dalam labu takar?
A: Jumlah pasti gram kalium dikromat yang ditambahkan ke labu takar bergantung pada konsentrasi dan volume larutan yang diinginkan.
T: Bagaimana Anda membedakan propanal dan propanon menggunakan kalium dikromat yang diasamkan?
A: Propanal akan dioksidasi menjadi asam propanoat oleh kalium dikromat yang diasamkan, sedangkan propanon (aseton) tidak menunjukkan reaksi.
T: Apakah kalium dikromat merupakan zat pereduksi?
J: Tidak, kalium dikromat adalah zat pengoksidasi.
Q: Bagaimana cara menulis rumus kalium dikromat?
A: Rumus kalium dikromat adalah K2Cr2O7.
