Kalium bromida (KBr) adalah senyawa kimia yang tersusun dari kalium dan brom. Ini biasa digunakan dalam fotografi, kedokteran dan kedokteran hewan sebagai antikonvulsan untuk anjing.
| Nama IUPAC | Kalium bromida |
| Formula molekul | KBr |
| nomor CAS | 7758-02-3 |
| Sinonim | Kalium Bromida, Garam Kalium Bromida, Kaliobromida, Bromopotassium |
| Di ChI | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
Sifat kalium bromida
Formula Kalium Bromida
Rumus kimia kalium bromida adalah KBr. Rumus ini mewakili rasio atom dalam senyawa. Ion K+ bermuatan +1 dan ion Bri- bermuatan -1 sehingga menghasilkan senyawa netral. Rumusnya digunakan untuk menunjukkan komposisi senyawa dan penting untuk menulis persamaan kimia yang seimbang.
Massa Molar Kalium Bromida
KBr memiliki massa molar 119,01 g/mol. Ini terdiri dari satu atom kalium dan satu atom brom. Massa molar merupakan ciri penting suatu senyawa karena digunakan untuk menentukan jumlah mol suatu zat dalam sampel tertentu. Ini juga digunakan dalam stoikiometri untuk menghitung massa suatu produk atau reaktan dalam reaksi kimia.
Titik didih kalium bromida
KBr memiliki titik didih 1.390 °C (2.534 °F). Titik didih yang tinggi ini disebabkan oleh sifat ionik senyawa tersebut. Saat dipanaskan, ikatan ion antara kalium dan brom memerlukan energi yang besar untuk memutuskannya, sehingga menghasilkan titik didih yang tinggi. KBr biasa digunakan di laboratorium sebagai fluida perpindahan panas karena titik didihnya yang tinggi.
Kalium bromida Titik lebur
KBr memiliki titik leleh 734°C (1.353°F). Sama seperti titik didih, titik leleh juga ditentukan oleh kekuatan ikatan ion antara atom kalium dan brom. Ketika dipanaskan, ikatan ion melemah dan struktur kisi kristal senyawa terurai, sehingga menghasilkan keadaan cair.
Massa jenis kalium bromida g/mL
Massa jenis KBr adalah 2,75 g/mL pada suhu kamar. Massa jenis suatu zat didefinisikan sebagai massa suatu zat per satuan volume. Kepadatan KBr yang tinggi disebabkan oleh struktur kristal senyawa yang rapat. Sifat ini membuatnya berguna dalam pembuatan bahan optik seperti lensa dan prisma.
Berat Molekul Kalium Bromida
Berat molekul KBr adalah 119,01 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom kalium dan bromin. Berat molekul digunakan dalam perhitungan kimia seperti menentukan jumlah suatu zat yang dibutuhkan untuk menyiapkan larutan dengan konsentrasi tertentu.
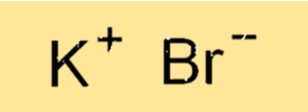
Struktur kalium bromida
KBr memiliki struktur kristal yang terdiri dari kisi kubik berpusat muka. Setiap ion K+ dikelilingi oleh enam ion Br-, dan setiap ion Bri- dikelilingi oleh enam ion K+. Susunan ini merupakan ciri senyawa ionik, yang mempunyai susunan ion yang teratur dan berulang dalam struktur kristalnya.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,75 g/mL pada 25°C |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 119,01 g/mol |
| Kepadatan | 2,75 gram/cm³ |
| Titik fusi | 734°C (1.353°F) |
| Titik didih | 1390°C (2534°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 53 g/100 mL pada 20°C |
| Kelarutan | Larut dalam alkohol, aseton dan amonia |
| Tekanan uap | 1 mmHg pada 1114°C |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 7,5 (pada 25°C) |
| pH | 7 (netral) |
Keamanan dan bahaya kalium bromida
KBr secara umum dianggap aman untuk digunakan, namun dapat menimbulkan beberapa bahaya jika salah penanganan. Ini mengiritasi kulit, mata dan pernafasan, dan jika tertelan dapat menyebabkan gangguan pencernaan. Kontak yang terlalu lama dengan konsentrasi tinggi dapat menyebabkan masalah pernapasan. KBr harus ditangani dengan hati-hati dan peralatan pelindung diri yang sesuai, termasuk sarung tangan dan masker debu, harus dipakai saat menangani senyawa tersebut. Penting juga untuk menyimpan KBr di tempat yang sejuk, kering, dan berventilasi baik, jauh dari bahan yang tidak kompatibel. Jika terpapar, segera dapatkan bantuan medis.
| Simbol bahaya | Xi – Menjengkelkan |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata. Kenakan pakaian pelindung, sarung tangan, dan kacamata/pelindung wajah yang sesuai |
| perlindungan. | |
| Nomor identifikasi PBB | UN 1465 (Bahan kimia, kalium bromida) |
| kode HS | 28275100 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (oral, tikus) = 2,340 mg/kg |
Metode sintesis kalium bromida
Untuk mensintesis KBr dapat menggunakan berbagai cara seperti sintesis langsung, dekomposisi ganda dan titrasi asam basa.
KOH bereaksi dengan gas HBr menghasilkan KBr dalam sintesis langsung. Reaksi tersebut menghasilkan KBr dan air sebagai produk sampingan.
Dekomposisi ganda melibatkan reaksi garam kalium larut dengan garam bromida larut, seperti kalium klorida dan natrium bromida. Reaksi tersebut menghasilkan KBr dan natrium klorida .
Titrasi asam basa melibatkan reaksi garam bromida dengan KOH . Asam sulfat encer terlebih dahulu mengolah garam bromida menjadi Hbr, kemudian KOH bergelar menghasilkan KBr dan air.
Metode lain untuk mensintesis KBr melibatkan mereaksikan brom dengan larutan panas kalium hidroksida . Natrium sulfit mereduksi kalium bromat, menghasilkan KBr dan kalium bromat.
Kegunaan Kalium Bromida
KBr memiliki beberapa kegunaan di berbagai industri karena sifatnya yang unik. Berikut beberapa kegunaan umum KBr:
- Fotografi: Banyak digunakan dalam fotografi hitam putih sebagai pemecah fotografi untuk mencegah kabut pada kertas foto.
- Kedokteran Hewan: Digunakan sebagai obat antikonvulsan untuk anjing dan kucing yang menderita kejang.
- Kimia Analitik: Digunakan sebagai standar acuan dalam Spektroskopi Inframerah Transformasi Fourier (FTIR) untuk mengidentifikasi senyawa organik.
- Kimia Obat: Digunakan dalam pembuatan berbagai obat-obatan, termasuk obat penenang, hipnotik, dan antiepilepsi.
- Pengeboran minyak: Digunakan sebagai cairan penyelesaian dalam pengeboran minyak untuk mencegah masuknya air formasi dan mengurangi risiko korosi.
- Tahan api: digunakan sebagai penghambat api pada plastik, tekstil, dan produk kertas.
- Sintesis kimia: Juga digunakan dalam reaksi sintesis kimia, terutama dalam sintesis berbagai senyawa organik dan anorganik.
Pertanyaan:
T: Dalam kondisi apa kalium bromida dapat menghantarkan listrik?
A: KBr dapat menghantarkan listrik bila dalam keadaan cair atau bila dilarutkan dalam air sehingga ion-ionnya dapat bergerak bebas dan membawa muatan listrik.
Q: Apakah KBr bersifat ionik atau kovalen?
A: KBr adalah senyawa ionik yang terbentuk melalui transfer elektron dari kalium ke brom.
Q: Apakah KBr larut dalam air?
A: Ya, KBr sangat larut dalam air, dengan kelarutan 53,5 g/100 mL pada 25°C.
T: Apa rumus kalium bromida?
A: Rumus kimia kalium bromida adalah KBr.
Q: Apakah KBr termasuk asam atau basa?
A: KBr merupakan garam dan tidak mempunyai sifat asam atau basa.
Q: Apa itu KBr?
A: KBr adalah simbol kimia untuk kalium bromida, senyawa ionik yang digunakan di berbagai industri karena sifat uniknya.
Q: Berapa massa KBr (dalam gram) yang diperlukan untuk menyiapkan 250,0 mL larutan KBr 1,50 M?
A: Untuk menyiapkan larutan 1,50 M KBr dalam 250,0 ml air, Anda perlu melarutkan 30,4 gram KBr dalam air.
