Fosfor triklorida adalah senyawa kimia yang terdiri dari fosfor dan tiga atom klor. Ini biasanya digunakan sebagai reagen dalam reaksi kimia dan sebagai prekursor senyawa organofosfat.
| Nama IUPAC | Fosfor triklorida |
| Formula molekul | PCl3 |
| nomor CAS | 7719-12-2 |
| Sinonim | Triklorofosfin, fosfor klorida, fosfor triklorida, fosfor (III) klorida |
| Di ChI | InChI=1S/Cl3P/c1-4(2)3 |
Sifat fosfor triklorida
Formula Fosfor Triklorida
Rumus fosfor triklorida adalah PCl3. Ini terdiri dari satu atom fosfor yang terikat pada tiga atom klor. Senyawa kimia ini banyak digunakan di berbagai industri dan laboratorium karena reaktivitas dan keserbagunaannya.
Massa Molar Fosfor Triklorida
Massa molar triklorofosfin dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Fosfor memiliki massa atom sekitar 31,0 gram per mol, sedangkan klor memiliki massa atom sekitar 35,5 gram per mol. Oleh karena itu, massa molar PCl3 kira-kira 137,3 gram per mol.
Titik didih fosfor triklorida
Triklorofosfin memiliki titik didih kurang lebih 76,1 derajat Celcius. Artinya bila dipanaskan akan berubah wujud dari cair menjadi gas. Titik didih merupakan sifat penting untuk dipertimbangkan ketika menangani dan menggunakan triklorofosfin dalam berbagai reaksi dan proses kimia.
Titik lebur fosfor triklorida
Titik leleh triklorofosfin kira-kira -112,7 derajat Celcius. Ia mengalami transisi fase dari padat ke cair pada suhu ini. Titik lebur merupakan karakteristik penting untuk menentukan keadaan fisik triklorofosfin dalam berbagai kondisi.
Massa jenis fosfor triklorida g/mL
Kepadatan triklorofosfin kira-kira 1,574 gram per mililiter. Massa jenis mewakili massa suatu zat per satuan volume dan memberikan gambaran tentang kekompakan dan berat material. Kepadatan triklorofosfin sering digunakan dalam perhitungan dan formulasi kimia.
Berat Molekul Fosfor Triklorida
Berat molekul triklorofosfin, dihitung dengan menjumlahkan berat atom penyusunnya, adalah sekitar 137,3 gram per mol. Berat molekul adalah parameter berharga untuk menentukan jumlah suatu zat dalam reaksi kimia dan merumuskan pengukuran yang tepat.
Struktur fosfor triklorida
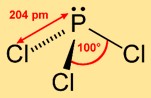
Triklorofosfin mengadopsi struktur piramida trigonal, di mana atom fosfor menempati puncak dan tiga atom klor membentuk alas segitiga. Susunan molekul ini berkontribusi terhadap reaktivitas kimianya dan memengaruhi perilakunya dalam berbagai reaksi.
Kelarutan fosfor triklorida
Triklorofosfin sulit larut dalam air, tetapi mudah larut dalam pelarut organik seperti benzena dan karbon tetraklorida. Sifat kelarutan triklorofosfin merupakan pertimbangan penting ketika menentukan pelarut yang cocok untuk digunakan dalam berbagai proses dan aplikasi kimia.
| Penampilan | Cairan tidak berwarna atau kuning pucat |
| Berat jenis | 1,574 gram/mL |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 137,3 g/mol |
| Kepadatan | 1,574 gram/mL |
| Titik fusi | -112,7°C |
| Titik didih | 76,1°C |
| Titik kilat | Tidak berlaku (Tidak mudah terbakar) |
| Kelarutan dalam air | Bereaksi dengan air |
| Kelarutan | Larut dalam pelarut organik seperti benzena dan karbon tetraklorida |
| Tekanan uap | 105 mmHg pada 25°C |
| Kepadatan uap | 4.83 (Udara = 1) |
| pKa | Tak dapat diterapkan |
| pH | Asam (pH <7) |
Keamanan dan bahaya fosfor triklorida
Triklorofosfin menimbulkan beberapa risiko keamanan dan harus ditangani dengan hati-hati. Ini sangat korosif terhadap kulit, mata dan sistem pernapasan. Kontak langsung dapat menyebabkan luka bakar parah dan kerusakan mata. Menghirup uapnya dapat menyebabkan iritasi pernafasan dan kerusakan paru-paru. Selain itu, triklorofosfin bereaksi hebat dengan air, melepaskan uap asam klorida yang beracun. Bahan ini mudah terbakar dalam kondisi tertentu dan kontak dengan zat pengoksidasi dapat menyebabkan kebakaran atau ledakan. Peralatan pelindung diri yang memadai, seperti sarung tangan, kacamata, dan respirator, harus digunakan saat menangani bahan kimia ini. Ventilasi yang memadai dan penyimpanan yang jauh dari bahan-bahan yang tidak kompatibel sangat penting untuk meminimalkan risiko.
| Simbol bahaya | Korosif, Beracun |
| Deskripsi Keamanan | – Menyebabkan luka bakar kulit yang parah dan kerusakan mata – Berbahaya jika tertelan, terhirup atau terserap – Bereaksi hebat dengan air, mengeluarkan asap beracun – Mudah terbakar dalam kondisi tertentu |
| Pengidentifikasi PBB | UN1809 |
| kode HS | 2812.10.00 |
| Kelas bahaya | 8 (Korosif), 6.1 (Beracun) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis fosfor triklorida
Berbagai metode mensintesis triklorofosfin. Pendekatan yang umum adalah memanaskan fosfor dengan gas klor berlebih, yang menyebabkan pembentukan triklorofosfin.
Metode lain melibatkan pemanasan fosfor pentaklorida (PCl5) dengan triklorofosfin (PCl3) untuk menghasilkan triklorofosfin.
Reaksi antara fosfor oksida (P2O5) dan asam klorida (HCl) menggabungkan kedua zat tersebut, biasanya dengan kondensor refluks, untuk memfasilitasi sintesis triklorofosfin.
Selain itu, pemanasan fosfor tribromida (PBr3) dengan triklorofosfin menghasilkan produksi triklorofosfin.
Penting untuk dicatat bahwa sintesis triklorofosfin harus dilakukan dengan tindakan pencegahan keselamatan yang tepat, karena melibatkan penanganan zat reaktif dan berbahaya. Pastikan keselamatan selama proses sintesis dengan menggunakan peralatan pelindung yang sesuai dan menjaga kondisi laboratorium yang berventilasi baik.
Secara keseluruhan, metode sintetik yang berbeda ini menawarkan pendekatan berbeda untuk memperoleh triklorofosfin, sehingga memberikan fleksibilitas dalam produksinya untuk berbagai aplikasi industri dan penelitian.
Kegunaan Fosfor Triklorida
Triklorofosfin banyak digunakan dalam beberapa aplikasi karena sifat serbaguna dan reaktivitasnya. Berikut adalah beberapa kegunaan utama:
- Reagen kimia: Berfungsi sebagai reagen penting dalam sintesis organik, terutama dalam produksi senyawa organofosfat. Ia berpartisipasi dalam reaksi seperti reaksi Vilsmeier-Haack dan reaksi Pudovik.
- Katalis: Triklorofosfin bertindak sebagai katalis dalam berbagai reaksi kimia, termasuk sintesis obat-obatan, pewarna, dan pestisida.
- Sumber Fosfor: Ini berfungsi sebagai sumber fosfor dalam produksi bahan kimia berbasis fosfor seperti asam fosfor dan fosfor oksiklorida.
- Tahan Api: Produsen menambahkan triklorofosfin sebagai penghambat api pada polimer, membantu mengurangi sifat mudah terbakar dan meningkatkan keamanan bahan terhadap api.
- Bahan antara kimia: Berbagai bahan kimia, termasuk obat-obatan, herbisida, insektisida, dan bahan pemlastis, diproduksi menggunakan triklorofosfin sebagai zat antara yang penting.
- Reagen Laboratorium: Laboratorium banyak menggunakan triklorofosfin sebagai reagen serbaguna untuk reaksi kimia, termasuk pembentukan asil klorida dan konversi alkohol menjadi alkil klorida.
- Pengolahan Air: Sifat oksidasi dan klorinasi yang kuat dari triklorofosfin menjadikannya komponen berharga dalam proses pengolahan air, yang secara efektif menghilangkan kotoran dan kontaminan.
- Farmasi: Triklorofosfin berperan dalam sintesis senyawa farmasi, termasuk obat untuk mengobati kanker, peradangan, dan gangguan saraf.
- Aplikasi pertanian: Ia menemukan aplikasi di bidang pertanian sebagai komponen pestisida dan herbisida tertentu, sehingga berkontribusi terhadap perlindungan tanaman dan pengendalian gulma.
- Manufaktur plastik: Produsen menggunakan triklorofosfin dalam produksi plastik dan bahan tambahan polimer untuk meningkatkan sifat material dan menjadikannya tahan api.
Berbagai aplikasi ini menyoroti pentingnya triklorofosfin dalam berbagai industri, penelitian, dan aplikasi sehari-hari.
Pertanyaan:
Q: Apakah fosfor triklorida termasuk basa atau asam?
Jawaban: Triklorofosfin adalah suatu asam.
Q: Berapa jumlah atom klor dalam molekul fosfor triklorida, PCl3?
J: Ada tiga atom klor dalam molekul triklorofosfin.
Q: Berapa persentase hasil reaksi dimana 200 g fosfor triklorida bereaksi?
A: Persentase hasil tidak dapat ditentukan tanpa informasi jumlah produk yang diperoleh.
Q: Berapa mol dalam 15 gram fosfor triklorida?
A: Terdapat sekitar 0,116 mol triklorofosfin dalam 15 gram.
T: Rumus apa yang mewakili senyawa molekul biner fosfor triklorida?
J: Rumus PCl3 adalah singkatan dari triklorofosfin.
T: Apa rumus fosfor triklorida?
A: Rumus fosfor triklorida adalah PCl3.
T: Apakah fosfor triklorida bersifat ionik atau kovalen?
A: Triklorofosfin adalah senyawa kovalen.
Q: Berapa jumlah atom klor dalam molekul fosfor triklorida, PCl3?
J: Ada tiga atom klor dalam molekul triklorofosfin.
T: Struktur Lewis triklorofosfin?
J: Struktur Lewis triklorofosfin memiliki atom fosfor pusat yang terikat pada tiga atom klor, dengan pasangan elektron bebas pada atom fosfor.
Q: Fosfor (P4) (s) + Klorin (g) → Triklorofosfin (l)?
A: Persamaan setara mewakili reaksi antara fosfor padat (P4) dan gas klor (Cl2) membentuk PCl3 cair.
T: Apa bentuk fosfor triklorida?
A: Triklorofosfin mempunyai bentuk piramida trigonal karena adanya sepasang elektron bebas pada atom fosfor.
T: Apakah fosfor triklorida merupakan senyawa ionik?
J: Tidak, triklorofosfin bukanlah senyawa ionik; itu adalah senyawa kovalen.
Q: Apakah fosfor triklorida mempunyai bidang refleksi?
J: Tidak, triklorofosfin tidak mempunyai bidang refleksi.
