Fosfor tribromida (PBr3) merupakan senyawa yang terdiri dari satu atom fosfor dan tiga atom brom. Ini digunakan sebagai reagen dalam berbagai reaksi kimia, terutama dalam sintesis senyawa organik.
| Nama IUPAC | Tribromida fosfor |
| Formula molekul | PBr3 |
| nomor CAS | 7789-60-8 |
| Sinonim | Fosfor(III) bromida, bromofosfor bromida, tribromofosfin |
| Di ChI | InChI=1S/Br3P/c1-4(2)3 |
Sifat fosfor tribromida
Formula Fosfor Tribromida
Rumus fosfor(III) bromida adalah PBr3. Ini terdiri dari satu atom fosfor dan tiga atom brom. Senyawa ini terbentuk ketika fosfor bereaksi dengan brom. Rumusnya secara akurat mewakili komposisi senyawa.
Massa Molar Fosfor Tribromida
Massa molar fosfor(III) bromida dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Fosfor memiliki massa atom sekitar 31,0 gram per mol, sedangkan brom memiliki massa atom sekitar 79,9 gram per mol. Menambahkan tiga kali massa atom brom ke massa atom fosfor menghasilkan massa molar fosfor(III) bromida, yaitu sekitar 270,7 gram per mol.
Titik didih fosfor tribromida
Fosfor(III) bromida memiliki titik didih kurang lebih 173 derajat Celcius. Artinya pada suhu di atas titik tersebut, senyawa akan mengalami perubahan fasa dari cair menjadi gas. Titik didih merupakan karakteristik penting yang membantu menentukan kondisi di mana suatu senyawa dapat digunakan atau dimurnikan.
Titik Leleh Fosfor Tribromida
Titik leleh fosfor(III) bromida kira-kira -41 derajat Celcius. Suhu ini menunjukkan titik di mana suatu senyawa berubah dari wujud padat menjadi cair. Mengetahui titik leleh sangat penting untuk menangani dan memanipulasi senyawa dalam berbagai proses kimia.
Kepadatan fosfor tribromida g/mL
Kepadatan fosfor(III) bromida kira-kira 2,85 gram per mililiter (g/mL). Massa jenis mengukur massa suatu zat per satuan volume. Dengan kepadatannya yang relatif tinggi, fosfor(III) bromida lebih padat dibandingkan banyak cairan umum lainnya, yang menunjukkan bahwa ia relatif berat dibandingkan volumenya.
Berat Molekul Fosfor Tribromida
Berat molekul fosfor(III) bromida kira-kira 270,7 gram per mol. Nilai ini dihitung dengan menjumlahkan massa atom seluruh atom dalam senyawa, berdasarkan rumus molekul PBr3. Berat molekul berguna dalam berbagai perhitungan, termasuk menentukan jumlah zat yang ada dalam suatu massa tertentu.
Struktur fosfor tribromida
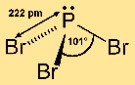
Fosfor(III) bromida memiliki struktur molekul piramidal. Ini terdiri dari atom fosfor pusat yang terikat pada tiga atom bromin. Susunan ini memberikan molekul bentuk piramida trigonal, dengan atom fosfor di bagian atas dan atom brom di dasar. Struktur ini penting untuk memahami reaktivitas dan perilaku senyawa dalam reaksi kimia.
Kelarutan fosfor tribromida
Fosfor(III) bromida sulit larut dalam air. Bereaksi dengan air menghasilkan asam hidrobromat dan asam fosfor. Namun, ia larut dalam pelarut organik seperti benzena dan karbon tetraklorida. Kelarutan menentukan sejauh mana suatu senyawa dapat larut dalam pelarut tertentu, yang berimplikasi pada penerapan dan penanganannya dalam berbagai proses.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 2,85g/ml |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 270,7 g/mol |
| Kepadatan | 2,85g/ml |
| Titik fusi | -41°C |
| Titik didih | 173°C |
| Titik kilat | Tidak tersedia |
| Kelarutan dalam air | Bereaksi |
| Kelarutan | Larut dalam pelarut organik seperti benzena dan karbon tetraklorida |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya fosfor tribromida
Fosfor(III) bromida menimbulkan beberapa risiko keselamatan dan harus ditangani dengan hati-hati. Bahan ini bersifat korosif dan dapat menyebabkan luka bakar parah jika terkena kulit, mata, atau sistem pernapasan. Menghirup atau menelan langsung senyawa ini dapat menyebabkan iritasi pernafasan dan pencernaan. Ia bereaksi hebat dengan air, melepaskan asap beracun dan menghasilkan panas. Ventilasi yang memadai dan peralatan pelindung diri, seperti sarung tangan dan kaca mata, harus digunakan saat bekerja dengan fosfor(III) bromida. Selain itu, harus disimpan jauh dari bahan yang tidak kompatibel untuk menghindari kemungkinan reaksi. Secara keseluruhan, kepatuhan yang ketat terhadap protokol keselamatan dan pengetahuan tentang bahaya yang terkait dengan senyawa ini sangat penting untuk penanganan yang aman.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Tangani dengan deposit. Hindari kontak dengan kulit, mata dan sistem pernafasan. Gunakan ventilasi yang memadai dan alat pelindung diri. Simpan jauh dari bahan yang tidak kompatibel. |
| Nomor identifikasi PBB | UN1805 |
| kode HS | 2812.90.90 |
| Kelas bahaya | 8 (Korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika terhirup dan tertelan. Dapat menyebabkan luka bakar dan iritasi parah. |
Metode sintesis fosfor tribromida
Dalam metode umum sintesis fosfor(III) bromida, wadah reaksi secara langsung menggabungkan unsur fosfor dan brom, biasanya dalam kondisi terkendali. Reaksi berlangsung dengan transfer atom brom ke atom fosfor, menghasilkan pembentukan fosfor(III) bromida.
Metode lain melibatkan reaksi antara fosfor triklorida (PCl3) dan hidrogen bromida (HBr) . Dalam pendekatan ini, fosfor triklorida pertama-tama bereaksi dengan gas hidrogen bromida, menghasilkan fosfor(III) bromida dan gas hidrogen klorida sebagai produk sampingan. Metode ini menawarkan jalur alternatif untuk memperoleh fosfor(III) bromida.
Dalam “metode fosfor merah”, fosfor merah digabungkan dengan brom atau asam hidrobromat dan reaksi dilakukan dalam kondisi terkendali. Fosfor merah berfungsi sebagai sumber fosfor, bereaksi dengan brom atau asam hidrobromat menghasilkan fosfor(III) bromida.
Metode sintetik ini membuka jalan bagi produksi fosfor(III) bromida, yang masing-masing memiliki kelebihan dan pertimbangannya sendiri. Pilihan metode bergantung pada faktor-faktor seperti ketersediaan reagen, hasil yang diinginkan, dan kondisi reaksi spesifik. Penting untuk melakukan sintesis ini di laboratorium yang lengkap, dengan menghormati protokol keselamatan dan prosedur penanganan bahan kimia yang terlibat.
Kegunaan Fosfor Tribromida
Fosfor(III) bromida menemukan berbagai aplikasi karena reaktivitas dan sifat uniknya. Berikut beberapa kegunaannya:
- Sintesis organik: Ahli kimia banyak menggunakan fosfor(III) bromida sebagai reagen dalam sintesis organik untuk mengubah alkohol menjadi alkil bromida, yang merupakan langkah penting dalam sintesis banyak senyawa organik.
- Industri Farmasi: Produksi obat-obatan sangat bergantung pada fosfor(III) bromida untuk mensintesis berbagai zat antara obat dan bahan aktif farmasi (API).
- Penghambat api: Produsen menggunakan fosfor(III) bromida dalam produksi penghambat api, meningkatkan sifat tahan api dari polimer tertentu untuk digunakan dalam industri seperti elektronik dan tekstil.
- Pembuatan bahan kimia: Fosfor(III) bromida berfungsi sebagai zat antara yang berharga dalam produksi bahan kimia lainnya, termasuk senyawa fosfor seperti turunan asam fosfat, fosfonat, dan fosfat.
- Herbisida dan Pestisida: Sintesis bahan aktif spesifik yang digunakan dalam herbisida dan pestisida menggunakan fosfor(III) bromida untuk mengendalikan gulma, hama, dan penyakit di bidang pertanian secara efektif.
- Penelitian Laboratorium: Di laboratorium, peneliti umumnya menggunakan fosfor(III) bromida sebagai reagen dalam berbagai eksperimen dan reaksi, terutama yang melibatkan brominasi dan manipulasi senyawa organik.
- Analisis kimia: Fosfor(III) bromida dapat diterapkan dalam teknik analisis kimia, memungkinkan penentuan keberadaan gugus fungsi tertentu dalam senyawa organik melalui reaksi substitusi brom.
Penggunaan yang beragam ini menyoroti pentingnya fosfor(III) bromida dalam sintesis organik, farmasi, penghambat api, manufaktur kimia, pertanian, penelitian laboratorium, dan analisis kimia. Reaktivitas dan keserbagunaannya menjadikannya senyawa yang berharga di berbagai industri dan disiplin ilmu.
Pertanyaan:
Q: Mengapa AlBr3 disebut aluminium bromida sedangkan PBr3 disebut fosfor tribromida?
J: Konvensi penamaan senyawa yang mengandung logam umumnya menggunakan nama unsur logam diikuti dengan nama bukan logam, sedangkan dalam kasus PBr3, fosfor ditentukan untuk menunjukkan adanya atom fosfor pusat.
T: Kata atau frasa dua kata manakah yang paling tepat menggambarkan bentuk fosfor tribromida?
J: Bentuk fosfor(III) bromida paling tepat digambarkan sebagai piramida trigonal.
Q: Berapa jumlah elektron valensi dalam molekul fosfor tribromida, PBr3?
A: Fosfor(III) bromida (PBr3) memiliki 26 elektron valensi.
T: Apakah fosfor tribromida bersifat ionik atau kovalen?
A: Fosfor(III) bromida (PBr3) merupakan senyawa kovalen.
T: Apa rumus kimia fosfor tribromida?
A: Rumus kimia fosfor(III) bromida adalah PBr3.
Q: Struktur Lewis untuk fosfor tribromida, PBr3?
J: Struktur Lewis PBr3 menunjukkan fosfor sebagai atom pusat yang dikelilingi oleh tiga atom brom yang terikat, masing-masing dihubungkan oleh satu ikatan.
T: Apakah PBr3 merupakan inversi?
J: Tidak, fosfor(III) bromida (PBr3) tidak menunjukkan inversi.
T: Apakah PBr3 merupakan elektrofil?
J: Ya, PBr3 dapat bertindak sebagai elektrofil dalam reaksi tertentu, dimana ia menerima elektron.
T: Apa geometri molekul PBr3?
A: Geometri molekul PBr3 adalah trigonal piramidal.
T: Apakah PBr3 bersifat polar atau non-polar?
A: PBr3 merupakan molekul polar karena distribusi kerapatan elektron yang tidak merata yang disebabkan oleh adanya ikatan polar P-Br.
Q: Berapa mol PBr3 yang mengandung 3,68 × 10^25 atom brom?
A: Untuk menentukan jumlah mol, kita membutuhkan massa molar PBr3, lalu kita membagi jumlah atom bromin dengan bilangan Avogadro.
T: Apa nama yang benar untuk PBr3?
J: Nama yang benar untuk PBr3 adalah fosfor(III) bromida.
T: Apakah PBr3 bersifat polar?
A: Ya, PBr3 merupakan molekul polar karena adanya ikatan polar dan distribusi kerapatan elektron yang tidak merata.
