Fosfor pentasulfida (P2S5) merupakan senyawa yang tersusun dari dua atom fosfor dan lima atom belerang. Ini digunakan dalam berbagai aplikasi termasuk produksi insektisida dan pelumas.
| Nama IUPAC | Fosfor pentasulfida |
| Formula molekul | P2S5 |
| nomor CAS | 1314-80-3 |
| Sinonim | Fosfor (V) sulfida; Difosfor pentasulfida; Sulfida fosfat; Fosfor pentasulfurisasi |
| Di ChI | InChI=1S/2P.5S |
Sifat fosfor pentasulfida
Rumus fosfor pentasulfida
Rumus fosfor pentasulfida adalah P2S5. Itu terdiri dari dua atom fosfor yang terikat pada lima atom belerang.
Massa Molar Fosfor Pentasulfida
Massa molar difosfor pentasulfida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Massa atom fosfor (P) kira-kira 30,97 g/mol dan belerang (S) kira-kira 32,07 g/mol. Oleh karena itu, massa molar P2S5 kira-kira 222,27 g/mol.
Titik didih fosfor pentasulfida
Difosfor pentasulfida memiliki titik didih sekitar 514 derajat Celcius (957 derajat Fahrenheit). Pada suhu ini, senyawa mengalami transisi fasa dari cair menjadi gas.
Titik lebur fosfor pentasulfida
Titik leleh difosfor pentasulfida kira-kira 280 derajat Celcius (536 derajat Fahrenheit). Ini adalah suhu di mana senyawa berubah dari padat menjadi cair.
Massa jenis fosfor pentasulfida g/mL
Kepadatan difosfor pentasulfida kira-kira 2,02 g/mL. Hal ini menunjukkan bahwa senyawa tersebut relatif padat, dengan massa per satuan volume yang tinggi.
Berat Molekul Fosfor Pentasulfida
Berat molekul difosfor pentasulfida, yang merupakan jumlah berat atom unsur-unsur penyusunnya, adalah sekitar 222,27 g/mol.
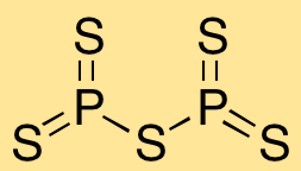
Struktur fosfor pentasulfida
Difosfor pentasulfida memiliki struktur molekul di mana dua atom fosfor terikat pada lima atom belerang. Susunan atomnya membentuk bentuk trigonal bipiramida, dengan atom fosfor di tengah dan atom belerang mengelilinginya.
Kelarutan fosfor pentasulfida
Difosfor pentasulfida sulit larut dalam air, yang berarti hanya larut sampai batas tertentu. Namun, ia lebih larut dalam pelarut organik seperti benzena dan karbon disulfida.
| Penampilan | Kuning padat |
| Berat jenis | 2.02 |
| Warna | KUNING |
| Bau | Bau yang menyengat |
| Masa molar | 222,27 g/mol |
| Kepadatan | 2,02 gram/ml |
| Titik fusi | 280°C (536°F) |
| Titik didih | 514°C (957°F) |
| Titik kilat | Tidak tersedia |
| Kelarutan dalam air | Sulit larut |
| Kelarutan | Larut dalam pelarut organik seperti benzena dan karbon disulfida |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya fosfor pentasulfida
Difosfor pentasulfida menimbulkan beberapa risiko keselamatan dan kehati-hatian harus dilakukan saat menanganinya. Bahan ini dapat menyebabkan iritasi parah dan luka bakar pada kulit, mata, dan sistem pernapasan jika terkena atau terhirup. Kontak langsung dengan senyawa harus dihindari dan sarung tangan pelindung, kacamata pelindung, dan peralatan pernapasan harus digunakan. Ia juga mudah terbakar dan dapat menyala jika terkena panas atau nyala api, menghasilkan oksida belerang yang beracun. Penyimpanan yang tepat jauh dari sumber api sangat diperlukan. Selain itu, difosfor pentasulfida tidak boleh dicampur dengan air atau zat reaktif karena dapat menghasilkan gas yang mudah terbakar atau beracun. Ventilasi yang baik dan kepatuhan terhadap protokol keselamatan sangat penting saat bekerja dengan senyawa ini.
| Simbol bahaya | Mudah terbakar, Mengiritasi |
| Deskripsi Keamanan | Menyebabkan luka bakar kulit yang parah dan kerusakan mata. Berbahaya jika terhirup. Benda padat yang mudah terbakar. |
| Nomor identifikasi PBB | PBB 1340 |
| kode HS | 2812120000 |
| Kelas bahaya | 4.2 (padatan mudah terbakar), 8 (korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Beracun |
Metode sintesis fosfor pentasulfida
Metode berbeda dapat digunakan untuk mensintesis difosfor pentasulfida.
Metode umum untuk mensintesis difosfor pentasulfida melibatkan pemanasan unsur fosfor dan belerang bersama-sama dalam lingkungan terkendali, biasanya dalam wadah tertutup. Suhu tinggi memfasilitasi reaksi, mengarah pada pembentukan difosfor pentasulfida.
Metode lain melibatkan pencampuran fosfor trisulfida (P4S3) dengan sulfur berlebih dan memanaskan campuran untuk mendorong reaksi. Sulfur berlebih bergabung dengan fosfor trisulfida, menghasilkan produksi difosfor pentasulfida.
Reaksi fosfor pentaklorida (PCl5) dengan hidrogen sulfida (H2S) dengan adanya pelarut yang sesuai, seperti karbon disulfida, memungkinkan pembuatan difosfor pentasulfida. Reaksi tersebut menghasilkan difosfor pentasulfida dan melepaskan gas hidrogen klorida (HCl) sebagai produk sampingan.
Harap berhati-hati saat menggunakan metode sintetis ini karena sifat berbahaya dari reagen dan produk yang terlibat. Pastikan tindakan keselamatan yang tepat, seperti menggunakan peralatan pelindung yang sesuai dan bekerja di area yang berventilasi baik, selama proses sintesis.
Kegunaan Fosfor Pentasulfida
Difosfor pentasulfida dapat diterapkan di berbagai industri dan proses karena sifatnya yang unik. Berikut beberapa kegunaannya:
- Produksi insektisida: Produsen menggunakan difosfor pentasulfida sebagai bahan utama dalam pembuatan insektisida, terutama yang ditujukan untuk mengendalikan hama seperti nyamuk dan kutu.
- Aditif pelumas: Perusahaan menambahkan difosfor pentasulfida ke pelumas sebagai aditif untuk meningkatkan tekanan ekstrim dan sifat anti ausnya. Aditif ini meningkatkan kinerja pelumasan dan melindungi mesin dalam kondisi tekanan tinggi.
- Sintesis kimia: Difosfor pentasulfida bertindak sebagai reagen dalam beberapa reaksi kimia, seperti sintesis tionil klorida (SOCl2), banyak digunakan dalam sintesis organik.
- Industri farmasi: Industri farmasi menggunakan difosfor pentasulfida dalam proses penelitian dan pengembangan untuk mensintesis senyawa dan zat antara tertentu.
- Ekstraksi logam: Proses metalurgi menggunakan difosfor pentasulfida untuk mengekstraksi logam tertentu, terutama tembaga dan seng, dari bijihnya. Ini membantu menghilangkan kotoran dan memfasilitasi pemurnian logam.
- Produksi pewarna dan pigmen: Difosfor pentasulfida berperan dalam sintesis berbagai pewarna dan pigmen, berfungsi sebagai bahan penyusun utama struktur kimianya.
- Agen Peperangan Kimia: Secara historis, difosfor pentasulfida telah digunakan dalam produksi agen perang kimia. Namun, perjanjian internasional secara ketat mengatur dan mengontrol penggunaannya untuk tujuan ini.
Penting untuk dicatat bahwa karena sifat berbahaya dari difosfor pentasulfida, tindakan dan protokol keselamatan yang tepat harus diikuti saat menangani, menyimpan, dan membuangnya.
Pertanyaan:
T: Apa itu dimer fosfor pentasulfida?
A: Dimer difosfor pentasulfida mengacu pada struktur molekul dua molekul fosfor pentasulfida yang terikat secara kimia.
T: Berapakah entropi fosfor pentasulfida?
J: Entropi difosfor pentasulfida mengacu pada pengukuran ketidakteraturan atau keacakan molekulernya pada suhu tertentu.
T: Berapa entalpi fosfor pentasulfida?
J: Entalpi difosfor pentasulfida mengacu pada kandungan panas atau perubahan energi yang terkait dengan reaksi atau transformasi kimianya.
T: Apa itu P2S5?
A: P2S5 adalah rumus molekul difosfor pentasulfida, senyawa yang terdiri dari dua atom fosfor yang terikat pada lima atom belerang.
Q: Berapa gram sulfur dalam 45,0 g P2S5?
A: 45,0 g P2S5 mengandung sekitar 28,13 g belerang.
Q: Berapa banyak molekul P2S5 yang diperlukan untuk membuat 222 gram?
J: Dibutuhkan sekitar 1,54 x 10^23 molekul P2S5 untuk setara dengan 222 gram.
T: Apa nama P2S5?
A: Nama P2S5 adalah fosfor pentasulfida.
Q: Apakah P2S5 merupakan elektrolit lemah?
J: Tidak, P2S5 bukanlah elektrolit lemah; itu adalah non-elektrolit.
T: Bagaimana saya mengetahui jika ukuran partikel P2S5 salah?
J: Ukuran partikel P2S5 yang salah dapat ditentukan dengan mengamati penyimpangan dari sifat fisik dan perilaku senyawa yang diharapkan.
T: Apa itu P2S5 ochem2?
J: “ochem2” bukanlah istilah atau sebutan yang dikenal untuk P2S5 dalam bidang kimia organik.
Q: Senyawa P2S5 disebut apa?
A: Senyawa P2S5 disebut difosfor pentasulfida.
Q: Apa itu P2S5 dalam kimia?
A: Dalam kimia, P2S5 mewakili rumus molekul difosfor pentasulfida, senyawa yang digunakan dalam berbagai aplikasi dan reaksi kimia.
